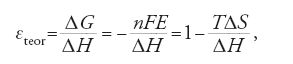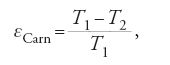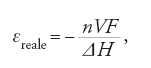La grande scienza. Celle a combustibile
La grande scienza. Celle a combustibile
Celle a combustibile
Una cella a combustione o, come viene più comunemente chiamata, 'cella a combustibile' è un dispositivo elettrochimico in grado di combinare l'idrogeno e l'ossigeno producendo acqua ed energia elettrica. Il principio di funzionamento di questo dispositivo fu scoperto nel 1839 dal fisico inglese William Grove, che realizzò e mise in opera la prima cella a combustibile. Cento anni dopo, Francis Bacon in Gran Bretagna sviluppò ulteriormente l'invenzione di Grove, dedicando particolare attenzione alla morfologia degli elettrodi e al ruolo del catalizzatore nel promuovere i processi di cella. Ulteriori sviluppi si sono avuti in seguito ai programmi spaziali, poiché le pile a combustibile sono state scelte come sistemi di alimentazione elettrica e rifornimento di acqua per importanti missioni, quali i programmi Gemini e Apollo negli anni Sessanta e, successivamente, i viaggi degli Shuttle. Oltre alle applicazioni nel settore spaziale, le celle a combustibile sono oggi utilizzate come impianti stazionari per la produzione in loco di elettricità per abitazioni o edifici pubblici e come fonti di energia nei veicoli elettrici o ibridi.
Principio di funzionamento
Il funzionamento di una cella a combustibile è basato sulla seguente reazione elettrochimica:
[1] H2(g)+1/2O2(g)→H2O(l)
vale a dire sulla reazione di combustione dell'idrogeno gassoso con l'ossigeno gassoso, che porta alla formazione di acqua. In questo processo l'idrogeno è il combustibile e l'ossigeno il comburente. L'ossigeno utilizzato normalmente proviene dall'aria, mentre l'idrogeno viene fornito sfruttando vari processi produttivi, tra cui l'elettrolisi dell'acqua, il cracking o il reforming in corrente di vapore di combustibili organici come il gas naturale, il metanolo e la benzina. Tra tutti questi processi di sintesi, solamente l'elettrolisi dell'acqua è in grado di produrre idrogeno puro, mentre dagli altri si ottengono miscele in cui l'idrogeno è presente con altri componenti gassosi, indesiderati per il corretto funzionamento del dispositivo.
In linea di principio una cella a combustibile è simile a una batteria, perché, come quest'ultima, è capace di convertire direttamente l'energia chimica in energia elettrica, combinando un elettrodo negativo, o 'anodo' (qui l'idrogeno), con uno positivo o 'catodo' (qui l'ossigeno) a contatto con un opportuno mezzo a conduzione di ioni o 'elettrolita'. Vi è tuttavia una netta differenza tra i due sistemi di produzione di energia: una batteria è un sistema chiuso che funziona consumando i componenti attivi agli elettrodi, mentre una cella a combustibile lavora grazie a un flusso di reagenti gassosi riforniti dall'esterno. La batteria è quindi limitata nella sua durata dalla quantità di reagenti che ha in sé e necessita di un processo di carica per ripristinare le sue condizioni iniziali, mentre una cella a combustibile garantisce una vita di esercizio continua fino a quando viene rifornita dei reagenti.
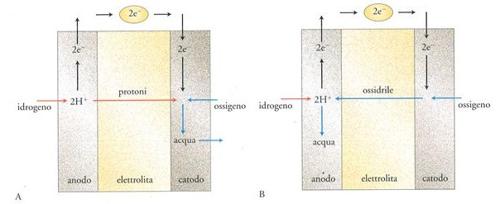
Una cella a combustibile opera secondo quanto schematizzato in fig. 1. L'idrogeno combustibile viene fornito all'elettrodo negativo dove si ossida a ione idronio H+ (protone) con cessione di elettroni. Gli elettroni fluiscono nel circuito esterno e producono lavoro elettrico, per poi giungere al catodo e ridurre a ione OH− (ossidrile) l'ossigeno qui rifornito. Il circuito è chiuso dal trasporto di ioni da un elettrodo all'altro attraverso l'elettrolita, con la formazione finale di acqua (Fuller 1997).
A seconda della natura dell'elettrolita usato (acido o basico), le reazioni dei singoli elettrodi possono essere scritte in modo diverso. Nell'elettrolita acido:
[2] anodo: H2→2H++2e−
[3] catodo: 1/2O2+2H++2e−→H2O
[4] totale: H2+1/2O2→H2O.
nell'elettrolita basico:
[5] anodo: H2+2OH−→2H2O+2e−
[6] catodo: 1/2O2+H2O+2e−→2OH−
[7] totale: H2+1/2O2→H2O.
Nel caso dell'elettrolita acido, il circuito elettrico viene chiuso dal trasporto di protoni che attraversano la cella dall'anodo fino a raggiungere il catodo per completare la reazione (fig. 1A), mentre nel caso dell'elettrolita basico sono gli ioni ossidrile che migrano dal catodo all'anodo (fig. 1B). In entrambi i casi il processo elettrochimico globale porta alla formazione di acqua e genera una forza elettromotrice E (o 'potenziale a circuito aperto') pari a 1,23 V a 25 °C.
In sintesi, il principio di funzionamento si basa sulla combustione di un carburante per produrre lavoro elettrico. Una cella a combustibile, quindi, può essere definita come un motore elettrico capace di convertire l'energia libera della reazione [1] in energia elettrica, allo stesso modo in cui avviene un processo di combustione in un motore termico. Tuttavia, il grande vantaggio di una pila a combustibile risiede nel fatto che essa, a differenza di quanto avviene in un motore termico, converte l'energia chimica in energia elettrica senza le limitazioni imposte dal ciclo di Carnot. Infatti, nella condizione di equilibrio a circuito aperto, la variazione di energia libera, ΔG, della reazione elettrochimica [1] può essere totalmente convertita in energia elettrica e l'efficienza termodinamica (rendimento) εteor del dispositivo è uguale a:
dove ΔH e ΔS sono rispettivamente la variazione di entalpia e di entropia della reazione [1], F è la costante di Faraday e n sono gli elettroni scambiati (due). Usando questi dati termodinamici possiamo valutare per il processo [1] a 25 °C un'efficienza pari a εteor≈80%.
L'efficienza teorica di una conversione indiretta, come quella che si ottiene in un motore termico, è invece definita dall'efficienza di Carnot, εCarn, esprimibile dall'equazione:
dove T1 è la temperatura della sorgente e T2 quella del sink (il serbatoio più freddo, al quale viene ceduto calore). Questa equazione implica che l'efficienza possa raggiungere un valore pari a 1 (100%) solamente se T2 è uguale allo zero assoluto, oppure se T1 approssima un valore infinito. Normalmente, la massima efficienza di Carnot è dell'ordine del 40% e diminuisce a circa la metà in condizioni reali.
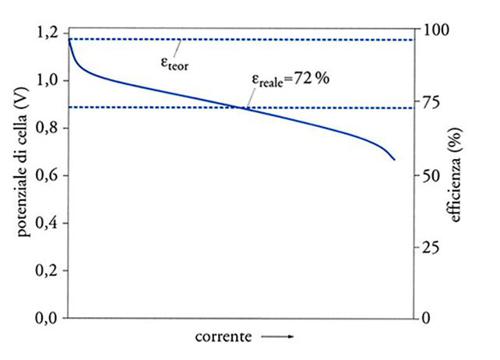
Anche nel caso della conversione diretta di una cella a combustibile vi è una diminuzione dell'efficienza passando dalle condizioni 'ideali' a circuito aperto (senza passaggio di corrente) a quelle reali, cioè sotto carico. Nei sistemi reali, parte dell'energia libera viene dissipata sotto forma di calore a causa delle resistenze della cella. Al fluire della corrente, infatti, il potenziale della cella V è più basso del valore di equilibrio E, e la differenza η cresce all'aumentare del valore della corrente:
[10] V=E−η.
Il termine η è definito 'sovratensione' e include le perdite di tensione agli elettrodi positivo e negativo, così come la caduta ohmica nella soluzione elettrolitica. L'efficienza reale εreale, quindi, in una cella a combustibile è data da:
e il suo valore diminuisce se la corrente aumenta. Tuttavia, come riportato schematicamente nella fig. 2, a un potenziale medio di lavoro pari a 0,9 V, l'efficienza è ancora di circa il 70%, un valore cioè più elevato di quello ottenibile da un motore a combustione. Sebbene il valore finale del rendimento dipenda anche da altri fattori legati ai processi collaterali, come il pompaggio, il riscaldamento, il raffreddamento e la compressione dei reagenti gassosi, così come agli altri componenti ausiliari della cella, l'elevata efficienza di conversione diretta rimane uno dei vantaggi chiave della tecnologia delle pile a combustibile.
Affinché la cella a combustibile possa operare efficacemente è sempre necessario un catalizzatore, poiché i processi elettrodici, come l'ossidazione dell'idrogeno (reazioni [2] e [5]) e la riduzione dell'ossigeno (reazioni [3] e [6]), procedono attraverso fenomeni di adsorbimento-desorbimento su un substrato solido, su cui l'idrogeno o l'ossigeno rilasciano o ricevono elettroni. Nel caso dell'ossidazione dell'idrogeno, per esempio, si può assumere che il processo si svolga attraverso una sequenza di passaggi, che inizialmente comporta il trasporto di una molecola d'idrogeno dalla fase gassosa al substrato solido e il suo adsorbimento sulla superficie; questo stadio è seguito dall'ossidazione elettrochimica dell'idrogeno adsorbito e infine dal rilascio nella fase elettrolitica delle specie che si sono formate. Il processo di riduzione dell'ossigeno è ancora più complesso, poichè implica un numero non ancora ben definito di passaggi paralleli e consecutivi, tra i quali la formazione di perossido di idrogeno come prodotto intermedio.
In virtù di questi meccanismi di reazione, si può comprendere come la velocità dei processi agli elettrodi sia influenzata dalla natura del substrato e in particolare dal valore di entalpia di adsorbimento dell'idrogeno o dell'ossigeno. Le cinetiche dei processi elettrodici, perciò, possono essere accelerate, e quindi le sovratensioni ridotte, scegliendo il substrato più opportuno. In altre parole il substrato agisce come un catalizzatore per le reazioni elettrodiche.
I più efficaci catalizzatori per il processo di ossidazione dell'idrogeno sono i metalli nobili, quali il platino, il palladio o il rutenio, mentre per la riduzione dell'ossigeno, oltre al platino e al palladio, possono essere usati il nichel oppure l'ossido di nichel nei regimi di alta temperatura. L'elevato costo di questi catalizzatori è il fattore che maggiormente influenza il costo globale di una cella a combustibile. L'uso di un substrato solido di platino non è ovviamente accettabile. Il buon funzionamento dei catalizzatori non dipende però soltanto dalla loro natura, cioè dalla loro struttura cristallografica ed elettronica, ma anche dalla loro morfologia: essi diventano via via più efficaci all'aumentare dell'area superficiale. Una maniera conveniente per raggiungere un efficace compromesso tra costo ed efficienza è perciò quella di progettare la struttura degli elettrodi in modo tale che il catalizzatore, per esempio il platino, risulti disperso come polvere sottile su un'ampia superficie di supporto, per esempio su un feltro di carbone.
Poiché i diversi tipi di celle a combustibile operano in un ampio intervallo di temperatura, che va da 100 °C fino a 1000 °C, la scelta del catalizzatore deve variare di conseguenza, passando dal platino per i regimi a bassa temperatura ai più convenienti composti di nichel per le celle ad alta temperatura.
Estremamente importante per il buon funzionamento di una cella a combustibile è prevenire la contaminazione dell'elettrodo con impurezze che potrebbero avvelenare il catalizzatore. Questo aspetto è particolarmente delicato per celle alimentate da flussi gassosi ottenuti da processi di cracking o di reforming di composti chimici, come l'alcol o il metano, che forniscono miscele contenenti, oltre all'idrogeno, anche altri componenti gassosi. Tra le sostanze dannose vi sono per esempio i composti solforati, e soprattutto il monossido di carbonio che, se presente anche in tracce, può distruggere il catalizzatore, ricoprendone i siti attivi superficiali. Il fenomeno è dovuto alla maggiore forza del legame Pt-CO rispetto a quella del legame Pt-H. La molecola di monossido di carbonio è in grado di legarsi al platino tenacemente, impedendo l'adsorbimento di idrogeno e portando alla rapida degradazione delle prestazioni della cella.
L'effettivo funzionamento di una cella a combustibile richiede dunque la realizzazione di un insieme elettrodico in grado di catalizzare il processo di ossidazione e/o di riduzione dei reagenti gassosi, assicurando allo stesso tempo il trasporto di elettroni nel circuito esterno. Per tener conto di questo requisito è necessario progettare opportunamente l'elettrodo, così da assicurare il trasporto dei reagenti gassosi nella zona dove avvengono i processi elettrodici, favorendo contemporaneamente la fuoriuscita dei prodotti. La progettazione di questa zona 'a tre fasi', in cui il gas deve venire in contatto con l'elettrolita liquido, assicurando lo svolgersi della riduzione, e anche con il substrato solido, garantendo il contatto con il catalizzatore disperso sulla superficie, così come il trasporto di elettroni al circuito esterno, è uno dei fattori critici nel funzionamento di una cella a combustibile. Una delle tappe fondamentali per il progresso di questi dispositivi è stata, infatti, la realizzazione di strutture porose modellate con canali tali da assicurare una efficiente distribuzione del gas entro tutto l'elettrodo e favorire al tempo stesso il contatto tra i componenti delle tre fasi. Ciò è stato conseguito usando substrati a elevato sviluppo superficiale, come quelli costituiti da polveri carboniose o metalliche che contengono il catalizzatore in forma finemente dispersa. Gli elettrodi di carbone poroso sono realizzati usando quali agenti leganti alcuni additivi plastici, come il politetrafluoroetilene, PTFE. Il contatto esterno è assicurato da collettori di corrente sotto forma di sottili fili metallici inglobati nella massa elettrodica. Gli elettrodi metallici a struttura porosa, invece, sono preparati per sinterizzazione delle opportune polveri. Nella moderna tecnologia delle celle a combustibile vengono comunemente impegnati entrambi i tipi di elettrodi, a seconda della struttura finale della cella.
Esistono due tipiche configurazioni di cella, quella monopolare e quella bipolare. La struttura monopolare viene scelta per la fabbricazione di moduli per elevate correnti. Qui i singoli elettrodi sono connessi in parallelo e forniti di connettori uniti l'uno con l'altro lungo i lati, per assicurare i contatti esterni. Poiché la raccolta efficiente di corrente richiede l'elevata conducibilità di tutto l'elettrodo, in questa configurazione vengono usati di preferenza elettrodi metallici porosi, che garantiscono tale caratteristica. La configurazione bipolare viene scelta per moduli a elevato potenziale. Gli elettrodi della singola cella sono connessi in serie e in questo caso i più adatti sono quelli a base di carbone poroso i quali, sebbene meno conduttivi, assicurano che la corrente che passa attraverso gli elettrodi venga raccolta da tutta la loro superficie.
Vi sono diverse tipologie di celle a combustibile, che differiscono per la temperatura d'esercizio e per il tipo di elettrolita usato. Una classificazione conveniente e comunemente accettata si basa sulla natura dell'elettrolita. Si possono quindi distinguere sei tipi differenti di celle a combustibile, come riassunto nella tab. 1: le celle a combustibile alcaline (AFC, alkaline fuel cell), le celle a combustibile ad acido fosforico (PAFC, phosphoric acid fuel cell), le celle a combustibile a membrana elettrolitica polimerica (PEMFC, polymer plectrolyte membrane fuel cell), le celle a conversione diretta di metanolo (DMFC, direct methanol fuel cell), le celle a carbonati fusi (MCFC, molten carbonate fuel cell) e le celle a ossidi solidi (SOFC, solid oxide fuel cell).
Nel seguito della trattazione verranno discusse più in dettaglio le caratteristiche delle varie tipologie.
Celle a combustibile alcaline
Le celle a combustibile alcaline (AFC) usano un elettrolita costituito da una soluzione concentrata di idrossido di potassio, KOH. Nelle prime realizzazioni l'elettrolita veniva fatto circolare attraverso gli elettrodi per rimuovere le eventuali impurezze e raffreddare il sistema. Infatti, il principale problema operativo di una cella AFC è costituito dall'intolleranza dell'elettrolita alcalino verso le impurezze acide, come il biossido di carbonio, CO2, che in un sistema alcalino può formare carbonati che precipitano sui pori degli elettrodi, bloccandone l'attività. Per questo le AFC possono funzionare solamente se come gas di alimentazione sono usati idrogeno e ossigeno a elevata purezza. D'altro canto, una AFC può funzionare a bassa temperatura, ha un elevato potenziale e una lunga vita operativa. Grazie a queste proprietà le celle alcaline sono state i primi sistemi scelti per applicazioni nelle missioni spaziali, come il programma Apollo della NASA negli anni Sessanta e in seguito il programma Shuttle (Kordesch e Simader 1996).
Le AFC sulla navetta Apollo impiegavano doppi elettrodi circolari a base di nichel poroso sinterizzato, ulteriormente attivato da un catalizzatore di platino metallico, e una soluzione all'85% di KOH come elettrolita. Quest'ultimo è solido a temperatura ambiente, ma liquefa intorno a 100 °C. Le AFC richiedevano un processo di attivazione e una temperatura d'esercizio di 200-230 °C. L'impianto di produzione di energia elettrica a base di celle a combustibile montato sulla navicella Apollo era costituito da tre moduli connessi in parallelo, ciascuno formato da 31 celle singole, connesse tra loro in parallelo. Moduli di AFC di differenti dimensioni sono stati utilizzati per fornire energia per diversi voli per la Luna, come per le missioni Skylab e Apollo-Soyuz (Kordesch e Simader 1996). In tempi più recenti moduli di celle AFC sono stati installati su Space Shuttle per rifornire di energia elettrica il veicolo, per produrre acqua per l'equipaggio e alimentare sistemi di raffreddamento. Seguendo il successo della NASA, i moduli AFC sono stati scelti anche dall'Agenzia spaziale europea (ESA) per le sue missioni (Kordesch e Simader 1996). Mentre le celle alcaline hanno avuto pieno successo nei programmi spaziali, dove l'elevato costo e il peso non rappresentano un fattore critico, esse hanno trovato invece limitate applicazioni in sistemi a terra, a causa di svantaggi intrinseci come la già citata intolleranza all'aria.
Celle a combustibile ad acido fosforico
Le celle a combustibile che hanno raggiunto il più elevato livello di commercializzazione sono quelle ad acido fosforico (PAFC), specialmente per applicazioni stazionarie, come gli impianti di produzione di energia elettrica in loco per case o edifici pubblici. La struttura di una PAFC si basa su elettrodi di carbone a elevato sviluppo superficiale con particelle disperse di Pt come catalizzatore tenute insieme da un legante a base di PTFE, a contatto con una soluzione elettrolitica di acido fosforico fortemente concentrata, immobilizzata in uno strato poroso di SiC posto tra gli elettrodi (Kordesch e Simader 1996). Il processo elettrochimico globale implica la riduzione dell'ossigeno al catodo, l'ossidazione dell'idrogeno all'anodo e il trasporto di ioni H+ attraverso l'elettrolita (tab. 1). La temperatura d'esercizio è intorno a 200 °C e quindi l'acqua viene prodotta come vapore. Ciò assicura alcuni vantaggi come il funzionamento con aria a pressione atmosferica e la minore intolleranza verso le impurezze. A differenza delle celle a combustibile che lavorano a bassa temperatura, una PAFC può tollerare CO in bassa percentuale senza che il catalizzatore si avveleni, permettendo quindi l'impiego come combustibile di gas naturali ottenuti da processi di reforming. In tal modo le PAFC lavorano con una miscela di CO2 al 20% e H2 all'80%, prodotti dal reforming in corrente di vapore del metano:
[12] CH4+2H2O → 4H2+CO2.
Nei sistemi PAFC e in tutti quelli che utilizzano combustibili da reforming, l'unità di lavoro è costituita, oltre che dalla cella a combustibile, da varie unità in serie tra le quali un processore per il combustibile (per rimuovere le specie contaminanti che avvelenano il catalizzatore, come i composti solforati), un'unità di reforming (dove il combustibile è mescolato al vapore e passando su catalizzatore è scisso in idrogeno e anidride carbonica), scambiatori di calore (per disperdere l'elevato calore prodotto) e, in caso di unità per la produzione di energia in loco, anche convertitori di tensione DC-AC.
Nonostante la configurazione a molte unità, le PAFC garantiscono una elevata efficienza di energia e per questo sono state scelte per lo sviluppo di impianti a elevata potenza. Le celle PAFC sono state anche montate in via dimostrativa su grandi veicoli quali autobus e camion.
Celle a combustibile a membrana elettrolitica polimerica
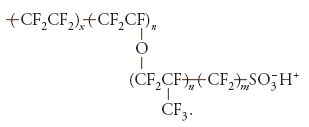
Le PEMFC sono caratterizzate dall'uso di una membrana polimerica come sistema elettrolitico. Tale membrana, che è un isolante elettronico ma diventa un conduttore protonico quando viene idratata, si basa su una catena polimerica fluorocarbonica alla quale sono attaccati gruppi solfonici. La membrana più usata è il Nafion®, la cui struttura di base è la seguente:
Questa può essere descritta come un acido perfluorosolfonico caratterizzato da una struttura simile al Teflon, sebbene presenti catene laterali a legame etereo, seguite da gruppi CF2 prima del gruppo solfonico acido. Sono state sviluppate anche altre membrane, dotate di catene laterali più corte e di un rapporto tra i gruppi SO3H e CF3 più grande, che conferisce una conducibilità specifica più elevata (Costamagna e Srinivasan 2001).
In queste membrane polimeriche il trasporto ionico è generalmente legato al trasferimento dei protoni attraverso i gruppi solfonici, in virtù di un meccanismo 'a salti' (processo di Grotthus). Poiché il salto tra siti è facilitato se il protone e i gruppi solfonici sono in forma solvatata, la membrana si comporta da isolante allo stato secco, e il trasporto ionico cresce progressivamente con il contenuto in acqua. Al massimo grado di idratazione la conducibilità raggiunge valori dell'ordine di 0,1 S∙cm−1, sufficientemente elevata da permetterne l'uso come separatore in una cella a combustibile.
Gli aspetti di pregio delle membrane perfluorosolfoniche acide risiedono da un lato nell'elevata affinità elettronica dell'atomo di fluoro, che essendo legato allo stesso tempo a un atomo di carbonio e al gruppo SO3− conferisce elevata acidità e quindi elevata conducibilità all'acido solfonico, e dall'altro nella grande stabilità dei gruppi CF2 al potenziale catodico, che garantisce lunghi tempi operativi. Al contrario, il maggior problema che è connesso con l'uso di queste membrane risiede nell'elevato costo. Ciò ha motivato un'intensa attività di ricerca e sviluppo verso la realizzazione di membrane protoniche ottenibili con differenti processi di sintesi o basate su diverse strutture chimiche. Fino a ora, comunque, le membrane tipo Nafion® rappresentano il sistema preferenziale per le PEMFC.
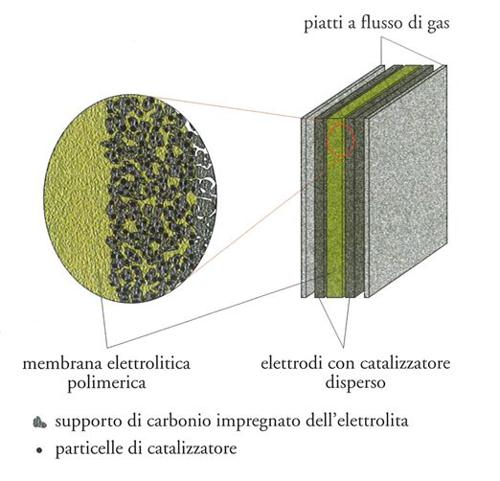
Lo schema di una cella PEMFC è mostrato nella fig. 4. L'anodo e il catodo sono elettrodi a diffusione di gas, formati tipicamente da feltri di carbone con particelle disperse di catalizzatore a base di Pt. L'idrogeno è ossidato all'anodo con formazione di protoni, che vengono trasportati attraverso la membrana fino a raggiungere il catodo, ove si combinano con l'ossigeno per formare acqua (si veda la tab. 1).
Uno dei fattori chiave nel funzionamento di una PEMFC è il cosiddetto MEA (membrane and electrode assembly), cioè la realizzazione di un supporto membrana-elettrodo in grado di garantire l'effettivo contatto del catalizzatore con il conduttore elettronico in feltro di carbone e contemporaneamente con la membrana a conduzione ionica. Ciò viene ottenuto impregnando prima la superficie del carbone che supporta il catalizzatore con una soluzione della membrana perfluorosolfonica acida e, successivamente, evaporando il solvente, in modo tale da poter ottenere alla fine l'incorporazione della membrana conduttrice all'interno dello strato attivo e poroso di diffusione gassosa. Tutto ciò comporta un'estensione della zona 'a tre fasi', in maniera simile a quanto avviene nelle celle a elettrolita liquido, consentendo di ottimizzare l'uso del catalizzatore.
Un fattore cruciale è poi la corretta gestione dell'acqua, se si considera che la disidratazione riduce la conducibilità protonica della membrana, mentre un eccesso nel contenuto di acqua conduce all''affogamento' degli elettrodi. Sono stati proposti diversi sistemi di controllo del contenuto di acqua nelle celle. Questi includono la rimessa in circolo dell'acqua accumulata al catodo oppure il rifornimento diretto di acqua attraverso gocciolatoi che connettono la membrana a una riserva esterna o, infine, l'umidificazione dei reagenti gassosi.
Un altro aspetto rilevante è la quantità del catalizzatore di platino nello strato elettrodico di diffusione gassosa. Una riduzione consistente, da 4 mg∙cm−2 di carico nei primi prototipi fino all'attuale 0,4 mg∙cm−2, è stata ottenuta usando particelle di platino di dimensione nanometrica (sostituendo i cristalliti di Pt puro) supportati su carbone a elevato sviluppo superficiale.
Il funzionamento efficace di una PEMFC richiede anche il controllo della pressione e della temperatura, come imposto dalla stabilità della membrana che non può eccedere di molto i 100 °C, così come la completa rimozione di impurezze di CO nel vapore combustibile, per prevenire gli effetti di avvelenamento del catalizzatore di platino. Il controllo può richiedere la filtrazione del gas in ingresso attraverso un reattore dove le tracce di CO sono ossidate selettivamente a CO2, oppure la scelta di un catalizzatore più tollerante verso CO. Un valido candidato è costituito da una lega Pt-Ru, un sistema cioè che possiede struttura e proprietà superficiali che diminuiscono la forza del legame con CO senza influenzare la sovratensione del processo di riduzione dell'idrogeno.
Le celle PEMFC sono state inizialmente sviluppate per i programmi spaziali, dove hanno trovato applicazione agli inizi degli anni Sessanta nei voli Gemini della NASA, per essere poi sostituite dalle celle AFC nelle missioni Apollo e Space Shuttle. In virtù dell'evoluzione della loro struttura e delle loro prestazioni, le celle a membrana polimerica stanno assumendo un ruolo chiave nei programmi che ne prevedono applicazione su veicoli elettrici. Infatti, tra i diversi tipi di celle a combustibile, le PEMFC assicurano le caratteristiche maggiormente richieste per applicazioni nelle automobili, come la bassa temperatura di esercizio e l'uso di un elettrolita chimicamente inerte. Sono previsti allestimenti a bordo formati da celle multiconnesse o dirette o ibride, le prime accoppiate a un motore elettrico, le seconde accoppiate a un motore elettrico munito di batteria di riserva. Sulla base di questi concetti, diverse case costruttrici automobilistiche negli Stati Uniti, in Giappone e in Europa stanno realizzando veicoli elettrici dimostrativi alimentati da celle PEMFC (Costamagna e Srinivasan 2001).
Le celle a combustibile a membrana polimerica potrebbero essere impiegate anche come sistemi d'alimentazione in apparecchiature elettroniche portatili. Questo settore di mercato è al momento dominato dagli accumulatori, come i sistemi nichel-idruro metallico e le batterie al litio. Tuttavia, le PEMFC hanno il vantaggio di tempi di carica più brevi e in linea di principio potenza specifica più alta. D'altro canto, la competitività verso la tecnologia già consolidata delle batterie potrà diventare realistica solamente quando saranno superate le più rilevanti limitazioni dei dispositivi PEMFC, come il funzionamento a temperatura ambiente o subambiente o il sistema di gestione dell'acqua.
Celle a combustibile a metanolo diretto
Una caratteristica peculiare di una cella a membrana polimerica PEMFC è che essa può essere alimentata con metanolo e operare così come cella a combustibile a metanolo diretto (DMFC). Viene qui a cadere la necessità di reforming del combustibile, poiché il metanolo è direttamente ossidato ad anidride carbonica all'anodo, mentre l'ossigeno è ridotto ad acqua al catodo, secondo il seguente schema di reazione:
[13] anodo: CH3OH+H2O → CO2+6H++6e−
[14] catodo: 3/2O2+6H++6e− → 3H2O
[15] totale: CH3OH+3/2O2 → CO2+3H2O.
I protoni che si formano all'anodo migrano al catodo attraverso la membrana per partecipare alla riduzione dell'ossigeno con formazione di acqua, mentre gli elettroni viaggiano verso il carico nel circuito esterno.
Le celle DMFC sono particolarmente promettenti per applicazioni nei veicoli elettrici, poiché lavorano a temperature medio-basse e, soprattutto, sono alimentate da metanolo, evitando la necessità di installare a bordo un sotto-sistema di trattamento del combustibile per ottenere idrogeno. Inoltre, il metanolo è un carburante con densità di energia gravimetrica e volumetrica di circa la metà rispetto alla benzina. Quindi un veicolo alimentato con una DMFC può in linea di principio viaggiare con il doppio dell'efficienza rispetto a uno alimentato da un motore a combustione interna, con emissioni inquinanti praticamente nulle (Ren et al. 2000).
Diversi progetti industriali e governativi sono attualmente in corso per dimostrare la fattibilità di veicoli elettrici a DMFC. Tuttavia lo sviluppo pratico è limitato da due importanti fattori operativi. Uno è legato alla bassa attività elettrocatalitica dei metalli nobili o delle loro leghe, anche a elevato carico, nei confronti dell'ossidazione del metanolo, con conseguenti perdite significative d'efficienza coulombiana. Alcuni progressi sono stati recentemente ottenuti con l'uso di leghe catalitiche 50% Pt-50% Ru. Il secondo fattore limitante di una DMFC è rappresentato dal fatto che il metanolo può passare dall'anodo al catodo attraverso la membrana perfluorosolfonica. Questo inconveniente, comunemente indicato come 'attraversamento del metanolo' e che è causato dalla permeabilità della membrana ad acqua e metanolo, diminuisce in maniera consistente l'efficienza della cella, poiché causa fenomeni di depolarizzazione degli elettrodi e perdite di conversione. Per questo motivo, i maggiori sforzi nel campo della ricerca e dello sviluppo delle celle DMFC sono al momento diretti verso la caratterizzazione di nuovi separatori elettrolitici a membrana, in grado di contrastare il passaggio del metanolo.
Celle a combustibile a carbonati fusi
Le celle a carbonati fusi (MCFC) operano a circa 650 °C sulla base dei seguenti processi elettrochimici:
[16] anodo: H2+CO32− → H2O+CO2+2e−
[17] catodo: 1/2O2+CO2+2e− → CO32−
[18] totale: H2+1/2O2 → H2O.
Le specie CO32− cariche negativamente sono trasportate attraverso l'elettrolita fuso dal catodo all'anodo e gli elettroni sono trasferiti dall'anodo al catodo attraverso il circuito esterno.
La moderna tecnologia delle MCFC usa anodi porosi Ni-10% Cr, catodi porosi litiati di NiO e una miscela elettrolitica fusa di Li2CO3-K2CO3 (o, alternativamente, Li2CO3-Na2CO3) supportata da una matrice ceramica a base di γ-LiAlO2. L'idrogeno è prodotto per gassificazione del carbone. Il processo anodico genera CO2, mentre sempre CO2 viene consumata al catodo. Risulta quindi opportuno trasferire l'anidride carbonica dall'anodo al catodo in modo da mantenere la composizione dell'elettrolita costante. Ciò viene ottenuto mescolando parte del gas anodico in uscita con il flusso di gas catodico (Kordesch e Simader 1996).
Il funzionamento di una MCFC è influenzato dalla pressione e dalla temperatura. La durata di una cella a combustibile a carbonati fusi, specialmente nelle strutture a moduli, è un problema critico per i fenomeni di corrosione associati all'ambiente aggressivo generato dall'elettrolita a carbonati fusi.
Celle a combustibile a ossidi solidi
Le celle a combustibile a ossidi solidi (SOFC) sono dispositivi allo stato solido che lavorano a temperature elevate, intorno a 1000 °C. L'elemento chiave di una SOFC risiede nell'elettrolita (indicato con la sigla YSZ), che è costituito da un materiale ceramico a base di zirconia, ZrO2, drogata con 8-10% di ittria, Y2O3. In seguito al drogaggio, alcuni ioni Y3+ sostituiscono lo ione Zr4+ nella struttura tipo fluorite della zirconia, generando un certo numero di siti vacanti per l'ossigeno, attraverso i quali gli ioni O2− possono muoversi. La conducibilità dello ione ossigeno nella zirconia stabilizzata con ittria, YSZ, è bassa a temperatura ambiente, e richiede un riscaldamento fino a circa 1000 °C per raggiungere valori paragonabili a quelli delle soluzioni liquide, cioè dell'ordine di 0,1 S∙cm−1.
La struttura di base di una SOFC consiste di due elettrodi porosi separati da uno strato elettrolitico denso di YSZ. L'ossigeno viene rifornito al catodo, dove viene ridotto a ione O2− che migra attraverso l'elettrolita, per raggiungere l'anodo e partecipare all'ossidazione dell'idrogeno, prodotto da reforming, o di una miscela H2/CO, e formare H2O e/o CO2, secondo lo schema di reazione seguente:
[19] catodo: O2+4e− → 2O2−
[20] anodo: 2H2+2O2− → 2H2O+4e−
e/o
[21] 2CO+2O2− → 2CO2+4e−
[22] totale: O2+2H2 → 2H2O
e/o
[23] 2CO+O2 → 2CO2.
Gli elettroni fluiscono dall'anodo al catodo attraverso il carico del circuito esterno.
Il potenziale a circuito aperto è più basso di quello di altre celle a combustibile, perché l'energia libera di formazione dell'acqua diviene meno negativa all'aumentare della temperatura. D'altro canto, l'elevata temperatura operativa della SOFC consente di raggiungere una elevata efficienza di conversione anche con l'uso di catalizzatori e materiali elettrodici poco costosi. Per il catodo viene impiegato in genere un ossido di lantanio e manganese, drogato con elementi alcalini e terre rare, mentre come anodo è usato il nichel. L'elettrolita è preparato in forma di film ceramico sottile per tenere la resistenza della cella entro valori bassi.
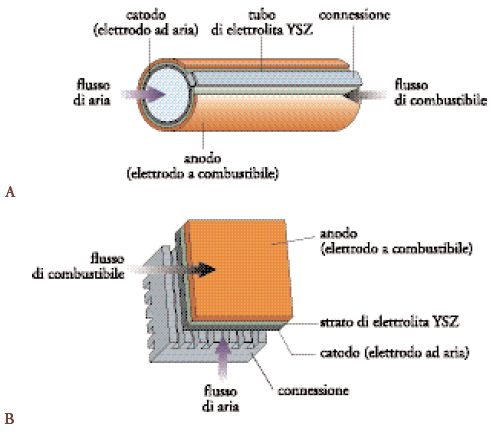
Uno dei problemi della SOFC, legato all'elevata temperatura di esercizio, è nella bassa compatibilità dei componenti dovuta ai differenti coefficienti di espansione termica. L'elevata temperatura influenza inoltre la scelta dei materiali di supporto, così come la geometria della cella. In genere vengono scelte due differenti tipologie di cella per i sistemi SOFC, tubolare o planare (fig. 5) (Ramanarayanan et al. 2001).
Nella geometria tubolare, i componenti della cella sono depositati in forma di strati sottili su un catodo a forma di tubo. Il catodo è formato in genere da un film poroso sinterizzato, di spessore di circa 1 mm, a base di manganite di lantanio drogata con stronzio; l'elettrolita è formato da uno strato di 40 μm di YSZ (depositato elettrochimicamente da fase vapore) e l'anodo è costituito da un film di Ni/YSZ di circa 150 μm di spessore. Nella cella a struttura planare i componenti sono realizzati in forma di lastre sottili e piane. L'elettrolita denso a base di YSZ è preparato o per deposizione su nastro, o per sinterizzazione delle polveri oppure per deposizione chimica da fase vapore, mentre gli elettrodi sono realizzati per stampaggio su lastra oppure mediante vaporizzazione termica.
Per entrambe le tipologie viene preferibilmente adottata la configurazione bipolare, utilizzando generalmente un ossido di cromo e lantanio drogato con magnesio come materiale di interconnessione elettrodico. Alla luce dei vantaggi, come l'elevata efficienza, e degli svantaggi, come l'elevato costo, le celle SOFC appaiono, al momento, adatte principalmente per impianti localizzati di produzione dell'energia. Tale applicazione è stata provata con successo attraverso la fabbricazione e il funzionamento di moduli in Giappone, negli Stati Uniti e in Europa. Gli obiettivi per la commercializzazione di celle SOFC rimangono la riduzione dei costi di fabbricazione e la conferma della vita d'esercizio sufficientemente lunga.
Il ruolo delle celle a combustibile nello scenario del trasporto senza emissioni
La crescente preoccupazione per il livello d'inquinamento atmosferico nelle grandi aree urbane esige interventi urgenti per il controllo delle emissioni di automobili e veicoli in circolazione. I veicoli a motore alimentati a benzina sono la fonte primaria di emissioni di monossido di carbonio, idrocarburi volatili e ossidi di azoto, cioè di tutti quei composti chimici inquinanti che sono responsabili della formazione di smog e di ozono a livello del suolo. È ormai ampiamente accettato che i problemi d'inquinamento urbano potrebbero essere attenuati con la sostituzione di una frazione consistente di automobili alimentate da motori a combustione interna con veicoli a emissione zero, cioè veicoli elettrici. In effetti, nella fase iniziale di produzione di automobili per il trasporto di passeggeri, la scelta più ovvia fu quella di alimentare il veicolo con un motore elettrico. Questo tipo di motore è infatti ideale per il trasporto urbano poiché è silenzioso e garantisce una maggiore efficienza rispetto a un motore a combustione. In effetti la popolarità del veicolo elettrico crebbe rapidamente e all'inizio del Novecento ne erano in circolazione diverse centinaia di unità; tuttavia l'espansione fu interrotta nel corso degli anni Venti per l'avvento dei veicoli a combustione interna, più veloci, più economici e in grado di assicurare maggiori percorrenze (Scrosati 1998). Questa tipologia di veicolo dominò rapidamente il mercato e al momento attuale ne sono in circolazione nel mondo alcune centinaia di milioni di esemplari.
L'inquinamento atmosferico nei centri urbani ha ormai raggiunto livelli che confermano drammaticamente come le emissioni delle automobili alimentate a benzina rappresentino un rischio elevato per la salute della popolazione e pertanto il concetto di veicolo elettrico a emissione zero ha riguadagnato interesse. In linea di principio il motore elettrico può essere alimentato da una batteria. Tuttavia, le batterie esistenti, come le piombo-acido, nichel-cadmio o anche nichel-idruro metallico, hanno un limitato contenuto in potenza ed energia, cosicché non sono in grado di assicurare regimi d'accelerazione e durata di percorrenza tali da rendere il veicolo elettrico interessante per il consumatore. Un ulteriore svantaggio risiede nel lungo tempo necessario per la ricarica della batteria. Infine, non va dimenticato che l'uso di un veicolo alimentato da una batteria non elimina completamente l'inquinamento poiché una fonte 'convenzionale' di energia elettrica (da petrolio o nucleare) è comunque necessaria per ricaricare la batteria; se tuttavia l'energia è prodotta in un impianto remoto, la sorgente d'inquinamento rimane confinata in un unico sito e quindi il suo impatto ambientale può essere accuratamente controllato.
Tenendo conto di tutte queste considerazioni, le celle a combustibile, e in particolare le PEMFC, appaiono ideali come fonti energetiche alternative per i veicoli elettrici. Il rifornimento di combustibile viene fatto direttamente 'a bordo' con serbatoi d'idrogeno (per PEMFC convenzionali) o con riserve di metanolo (per DMFC), eliminando in tal modo qualsiasi fonte di inquinamento e riducendo praticamente a zero il tempo necessario per la ricarica, vale a dire due dei principali inconvenienti associati all'uso di una batteria. L'energia e la potenza di una PEMFC, inoltre, possono risultare adeguate per assicurare prestazioni di guida che, se ancora non paragonabili totalmente a quelle dei veicoli a benzina, possono tuttavia rendere il veicolo elettrico appetibile per un'ampia fascia di utenti. Numerosi progetti governativi e privati mirati all'utilizzazione di celle a combustibile come sistemi di alimentazione per auto sono oggi in corso di attuazione, e alcune case automobilistiche negli Stati Uniti, in Giappone e in Europa stanno realizzando prototipi di veicoli elettrici alimentati da PEMFC. Il maggior problema che ancora limita la produzione su larga scala è legato ai costi. D'altro canto, gli sforzi attualmente diretti a minimizzare la quantità di catalizzatore nella struttura elettrodica e a caratterizzare nuove membrane, forniscono buoni indizi circa l'identificazione di strutture di cella alternative, che a loro volta possono favorire la riduzione dei costi delle celle a combustibile, specialmente se prodotte industrialmente. Tenendo conto di queste prospettive, la circolazione nelle nostre città di auto ecologiche alimentate da celle a combustibile non appare più un traguardo irraggiungibile.
Bibliografia
Costamagna, Srinivasan 2001: Costamagna, Paola - Srinivasan, Supramanian, Quantum jump in the PEMFC science and technology from the 1960s to the year 2000. Part I. Fundamental scientific aspects; Part II. Engineering, technology development and application aspects, "Journal of power sources", 102, 2001, pp. 243-270.
Fuller 1997: Fuller,Thomas F., Is a fuel cell in your future ?, "Interface", 6, 1997, pp. 26-39.
Kordesch, Simader 1996: Kordesch, Karl - Simader, Günter, Fuel cells and their applications, Weinheim, VCH, 1996.
Ramanarayanan 2001: Ramanarayanan, Trikur A.- Singhal, Subhash - Wachsman, Eric D., High temperature ion conducting ceramics, "Interface", 10, 2001, pp. 22-27.
Ren 2000: Ren, Xiaoming - Zelany, Piotr - Thomas, Sharon - Davey, John - Gottsfeld, Shimshon, Recent advances in direct methanol fuel cells at Los Alamos National Laboratory, "Journal of power sources", 86, 2000, pp. 111-119.
Scrosati 1998: Scrosati, Bruno, The electric vehicles. Effective tools for air quality improvement in urban areas, "La chimica e l'industria", 80, 1998, p. 1045.
Wilkinson 1997: Wilkinson, David P., Fuel cells. An electrochemical solution to global climate change in the 21st Century, "Interface", 10, 1997, pp. 22-25.