dolore
dolore
Il dolore può essere definito come un’esperienza sensoriale ed emozionale spiacevole associata a un danno tissutale effettivo o potenziale. Nella reazione di dolore sono infatti presenti componenti sensitive, affettive e cognitive che interagiscono confluendo nella risposta complessa dell’individuo. Da un lato il dolore rappresenta un meccanismo di allerta, e serve al soggetto come sistema protettivo, volto a minimizzare un danno tissutale e a evitare stimoli nocivi. Il dolore tuttavia può cronicizzarsi e diventare patologico, causando conseguenze più deleterie dello stesso stimolo che ne è all’origine. Il dolore deriva dall’attivazione di specifici recettori (nocicettori) distribuiti a livello cutaneo, muscolare, articolare e viscerale. Il segnale dolorifico viene trasmesso dai nocicettori alle corna dorsali del midollo spinale, da qui al talamo e infine alla corteccia cerebrale. Esistono anche vie discendenti deputate alla modulazione del segnale dolorifico. Un danno alle vie di trasmissione/modulazione del segnale dolorifico può causare dolore (dolore neuropatico). Le varie terapie del dolore sono basate sulla possibilità di bloccare la sensazione dolorosa in un punto periferico o centrale del sistema nervoso. [➔ analgesia; cervello, struttura e funzione; corteccia cerebrale; neuropeptidi; neurotrasmettitori] La definizione del d. proposta dall’Associazione internazionale per lo studio del dolore (International association for study of pain, IASP), quale esperienza sensoriale ed emozionale spiacevole associata a un danno tissutale effettivo o potenziale, stabilisce che il d. consta di due componenti: una componente sensoriale, innescata dalla stimolazione di specifici recettori distribuiti nell’organismo, e una componente emozionale, che rende le reazioni al d. estremamente soggettive e condizionate da fattori individuali. Il d. rappresenta da un lato un sistema di difesa, quando codifica un segnale d’allarme per una lesione tissutale e consente ricezione e trasporto al sistema nervoso centrale di stimoli potenzialmente lesivi per l’organismo. In queste condizioni, il d. (detto d. acuto o fisiologico) svolge un ruolo protettivo, e serve a modificare alcune risposte comportamentali, assicurando che il soggetto possa evitare stimoli aggressivi o nocivi. Il d. diventa invece patologico/ cronico quando perde questa funzione di allerta e si automantiene, in seguito a modifiche che conducono all’ipereccitabilità dei circuiti di percezione e alla deregolazione dei circuiti di controllo. In tali situazioni, il d. può determinare disordini comportamentali, metabolici e funzionali molto gravi.
Classificazione del dolore
Il d. può essere classificato in nocicettivo, neuropatico e idiopatico. Si ha il d. nocicettivo quando è conseguente all’attivazione degli specifici recettori per il d. (➔ nocicettore). Il d. nocicettivo a sua volta si divide in d. somatico (quando proviene dai nocicettori che si trovano a livello cutaneo, muscolare e articolare) e d. viscerale (se interessa le strutture viscerali). Un altro tipo di d. è il d. neuropatico, in cui un danno colpisce proprio il sistema di percezione del d., sia a livello periferico sia a livello di sistema nervoso centrale. Il d. che non è apparentemente associato ad alcuna alterazione in strutture somatiche o nervose si definisce d. idiopatico.
Trasmissione dell’impulso doloroso
La percezione del d. è il risultato di una serie di processi fisiologici: la trasduzione di uno stimolo nocivo (per es., calore o pressione elevati, danno tissutale) in un segnale elettrico da parte dei nocicettori; la trasmissione del messaggio, lungo fibre sensitive afferenti primarie, dai nocicettori all’encefalo; la modulazione del messaggio, man mano che esso attraversa le sinapsi presenti nel sistema nervoso centrale (con possibilità di amplificare o inibire il segnale dolorifico); infine l’integrazione, evento fortemente soggettivo, della serie di eventi elettrochimici appena menzionati, risultante nell’esperienza finale di rappresentazione interna del dolore.
Trasduzione del segnale dolorifico
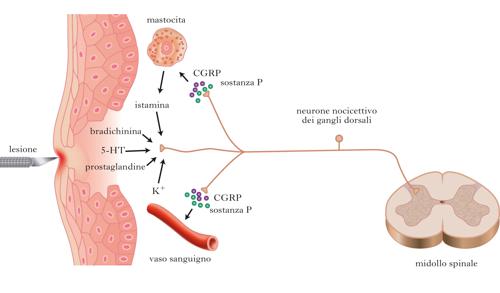
La trasduzione dei segnali dolorifici è affidata a terminazioni nervose localizzate a livello cutaneo, muscolare, articolare e viscerale. Tali terminazioni nervose appartengono a cellule nervose posizionate in prossimità della colonna vertebrale e organizzate in gangli (detti gangli dorsali o gangli spinali), uno per ciascuna vertebra e per ciascun lato del corpo. I neuroni dei gangli dorsali sono cellule a T, con una terminazione deputata a ricevere segnali in periferia, e una terminazione che penetra nelle corna dorsali del midollo spinale. La sensibilità dolorifica che proviene dal distretto facciale è veicolata invece dalle fibre del nervo trigemino (il quinto paio di nervi cranici); i corrispondenti corpi cellulari si trovano alla base del cranio. Le vie per la sensibilità dolorifica sono costituite da due varietà di fibre, dette fibre Aδ e fibre C, che conducono il segnale a differenti velocità. In partic., le fibre Aδ sono mielinizzate (velocità di conduzione 5÷30 m/s) e rispondono a stimoli nocivi di natura meccanica e termica. Le fibre Aδ sono responsabili del d. iniziale, pungente e localizzato, che fa seguito all’applicazione di uno stimolo nocivo. Le fibre C sono invece non mielinizzate (velocità di conduzione minore a 1 m/s) e sono polimodali, rispondono cioè a stimoli nocivi di origine meccanica, termica e chimica (costituiti per es. da mediatori infiammatori). Le fibre C sono responsabili della percezione di un d. più diffuso, sordo e persistente che fa seguito alla prima risposta. Il d. inizia tipicamente con una lesione alle strutture di qualche sistema, organo o tessuto. Il danno può innescare un processo infiammatorio, in seguito al quale un gran numero di sostanze viene rilasciato perifericamente a livello del tessuto leso (per es., ioni potassio, serotonina, bradichinina, istamina, ossido nitrico, prostaglandine e citochine). Il rilascio di queste sostanze aumenta l’eccitabilità delle fibre sensitive, e quindi incrementa la trasduzione dello stimolo nocivo, per cui segnali di bassa intensità che normalmente non causano d. sono invece percepiti come dolorifici.
Trasmissione del segnale dolorifico
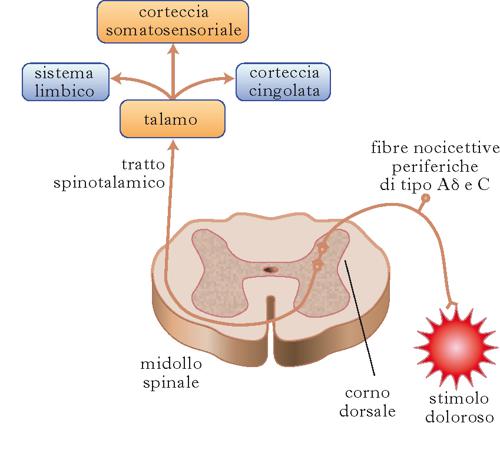
Gli stimoli dolorifici vengono trasformati in segnali elettrici dai nocicettori e tali segnali (nella forma di potenziali d’azione generati da canali per il sodio voltaggio-dipendenti) viaggiano lungo le fibre sensitive afferenti primarie, e vengono trasmessi alle corna dorsali del midollo spinale. La trasmissione sinaptica tra le fibre nocicettive e i neuroni spinali è mediata principalmente dal rilascio di glutammato, il più comune neurotrasmettitore eccitatorio a livello di sistema nervoso centrale. Tuttavia, la trasmissione del segnale avviene anche attraverso il rilascio di neuropeptidi, tra i quali la sostanza P, e di fattori neurotrofici, come il BDNF. Il rilascio di queste sostanze è in grado di modulare in maniera molto signi;ficativa l’eccitabilità dei neuroni delle corna dorsali (➔ iperalgesia). Inoltre, l’attività neuronale nelle corna dorsali è fortemente influenzata da vie discendenti inibitorie che originano da centri superiori dell’encefalo, come la sostanza grigia che circonda l’acquedotto di Silvio (griseum periaquaeductalis, localizzato nel mesencefalo) e la sostanza grigia periventricolare (situata lateralmente all’ipotalamo). Queste aree attivano vie discendenti che rilasciano modulatori (oppioidi endogeni, noradrenalina, serotonina), capaci di inibire gli stimoli dolorosi afferenti a livello delle corna dorsali del midollo spinale. Dalle corna dorsali del midollo spinale, la trasmissione del segnale dolorifico ai centri superiori avviene principalmente lungo tre vie: il tratto spinotalamico, quello spinoreticolare e quello spinomesencefalico.
Modulazione del segnale dolorifico
A livello delle varie stazioni sinaptiche, fenomeni di sommazione, facilitazione e inibizione determinano modificazioni e successive elaborazioni degli stimoli dolorifici. In partic., il fascio spinotalamico rappresenta la principale via dolorifica ascendente dal midollo spinale. Gli assoni spinotalamici si portano nel midollo spinale controlaterale (decussazione), e dopo aver attraversato il bulbo, il ponte e il peduncolo cerebrale (mesencefalo), hanno la loro terminazione nel nucleo ventrale posterolaterale del talamo, in contiguità col nucleo ventrale posteromediale in cui terminano le fibre dolorifiche d’origine trigeminale.
Integrazione del segnale dolorifico
Una parte degli stimoli dolorifici dal talamo viene condotta all’ipotalamo, che diventa responsabile dell’attivazione di una serie di reazioni endocrine e neurovegetative che possono associarsi al d., come nausea, vomito, bradicardia o tachicardia e ipertensione. Il talamo trasmette inoltre le informazioni ricevute alla corteccia cerebrale dove si realizza il meccanismo della percezione, dell’analisi e della memorizzazione, ossia della coscienza dell’evento doloroso. I neuroni di diverse aree cerebrali sono in grado di rispondere a stimoli dolorosi. In partic., le aree talamiche proiettano alla corteccia somatosensitiva localizzata nel giro postcentrale. Altre due aree corticali, il giro cingolato e la corteccia insulare, sono coinvolte nel processo di eleborazione della dimensione psicoemotiva del dolore.
Dolore neuropatico
In contrasto con il d. nocicettivo, che è susseguente alla stimolazione specifica delle vie dolorifiche afferenti al midollo spinale, il d. neuropatico viene definito dalla IASP come d. associato a lesione primaria o disfunzione del sistema nervoso. Il d. neuropatico può essere periferico, se la lesione è situata a livello di sistema nervoso periferico, o centrale, se le alterazioni nervose sono localizzate nel midollo spinale e nell’encefalo. Per quanto riguarda il d. neuropatico periferico, la lesione nervosa può essere ricondotta a varie entità eziopatogenetiche: per es., le forme traumatiche e la forma posterpetica (susseguente a riattivazione del virus varicella-zoster); inoltre in clinica medica è classica la forma diabetica. Il d. neuropatico centrale può essere riconducibile a eventi ischemici, specie nei casi in cui il danno neuronale sia localizzato nel tronco encefalico. Alcuni possibili meccanismi che determinano il d. neuropatico sono: un aumento della scarica nocicettiva primaria afferente (per es. quando, in seguito a una lesione, i canali del sodio che mediano la trasmissione del segnale sono iperattivi, o anomali, o in numero maggiore); un’aumentata eccitabilità delle strutture centrali, in seguito alla loro deafferentazione; una ridotta attività inibitoria a livello di sistema nervoso centrale; un’alterata elaborazione del segnale a livello centrale, tale da trasformare un segnale normale in doloroso.
Misurazione del dolore
Il d. ha una componente fisica e una psicologica; entrambi questi aspetti vanno considerati per una corretta diagnosi della sindrome dolorosa, e per un’adeguata valutazione dell’efficacia di strategie terapeutiche.
Per misurare il d. è necessario un approccio integrato. Da un lato, è a volte impossibile esaminare il rapporto fra nocicezione e risposta al d., poiché in certe sindromi dolorose (per es., nella sindrome dell’arto fantasma, ➔), lo stimolo originale è assente. D’altro canto, sebbene il d. sia un’esperienza soggettiva, esistono variabili fisiologiche che lo accompagnano e che possono essere misurate: queste includono variazioni della frequenza cardiaca e della tensione dei muscoli, e alterazioni dell’attività elettrica e metabolica nel sistema nervoso centrale. L’invalidità, espressa come mancanza di movimento, incapacità lavorativa o difficoltà nelle relazioni interpersonali, e certi atteggiamenti associati al d., che si esprimono con smorfie facciali, vocalizzazione e atteggiamenti posturali, possono essere anch’essi analizzati e misurati da un osservatore. Altre variabili del d., come intensità, frequenza e qualità, devono essere valutate con metodi soggettivi come l’autodescrizione. Clinicamente, la valutazione deve comprendere aspetti oggettivi e soggettivi relativi a sviluppo, natura, intensità, localizzazione e durata della percezione dolorosa. È attualmente disponibile una serie di strumenti per la misurazione del d., di diversa complessità, in grado di raccogliere e valutare dati di natura soggettiva. La scala analogica visiva è uno dei più comuni test di autodescrizione. In essa, al soggetto viene presentata una linea di 10 cm (orizzontale o verticale) con due punti di inizio e fine, corrispondenti ad ‘assenza di d.’ e al ‘d. peggiore mai sentito’, e viene chiesto di tracciare sulla linea un segno che rappresenti il livello di d. provato. Questa prova è semplice, può essere facilmente ripetuta nel tempo, e ha dimostrato validità e affidabilità. Un altro metodo semplice di misura del d. è costituito dalla scala di espressioni facciali. Queste scale consistono generalmente in una serie di disegni raffiguranti diverse espressioni facciali, che rappresentano le variazioni di gravità del dolore. Il soggetto è chiamato a valutare il suo d. scegliendo il disegno che rappresenta il livello della propria esperienza dolorosa. Questa tecnica viene applicata spesso nel caso dei bambini, che non sono in grado di compilare una scala analogica visiva prima dei 7 anni. Per descrivere più compiutamente l’esperienza del d., sono state prodotte anche scale più complesse, per es. il McGill pain questionnaire (originariamente sviluppato al’Università McGill di Montreal). In questo test il soggetto deve selezionare da una lista i termini che descrivono più accuratamente la percezione del proprio dolore. I termini sono suddivisi in tre classi maggiori: sensoriale (termini utilizzati per descrivere la sensazione stessa), emotivo-affettiva (descrizione di ciò che la sensazione induce nel soggetto), valutativa (esprimente il grado di sofferenza). Infine, un ulteriore e utile test di valutazione è rappresentato dalle mappe del dolore. In questo test, ai pazienti viene chiesto di segnare le parti di una figura umana nelle quali viene avvertito il d. in uno specifico momento. La mappa può essere utile per valutare sede e distribuzione del dolore.
Terapia del dolore
I farmaci attualmente in uso per il d. acuto sono rappresentati dagli anestetici locali, dai farmaci antinfiammatori non steroidei, dai corticosteroidi e dagli oppioidi (➔ analgesia). Gli anestetici locali (come la bupivacaina) sono usati nel trattamento del d. acuto soprattutto per ottenere blocchi nervosi periferici; il loro meccanismo d’azione si basa sul blocco dei canali sodio voltaggio-dipendenti, che trasportano l’informazione nocicettiva afferente al midollo spinale. I farmaci antinfiammatori non steroidei comprendono un’ampia famiglia di agenti con azione similare ma con diversa struttura chimica. Il capostipite di questa famiglia è l’acido acetilsalicilico; questi farmaci inibiscono selettivamente la biosintesi delle prostaglandine, e tramite questo meccanismo bloccano la risposta nocicettiva ai mediatori endogeni dell’infiammazione come la bradichinina. Similmente, i corticosteroidi agiscono tramite l’effetto antinfiammatorio e mediante una postulata riduzione dell’eccitabilità neuronale con azione diretta sulla membrana cellulare. Una delle sfide future della terapia del d. risiede proprio nella possibilità di poter controllare in maniera più selettiva il processo infiammatorio, in modo da abolirne gli aspetti indesiderati come il d., lasciando invece intatte le funzioni protettive e ricostruttrici. Farmaci antidolorifici ad azione centrale sono invece gli oppioidi, come la morfina. Queste molecole mimano l’azione delle sostanze oppiacee endogene, che controllano normalmente il flusso dell’informazione dolorifica a livello dell’encefalo e delle corna dorsali del midollo spinale. Per quanto riguarda il d. neuropatico, la conoscenza incompleta dei meccanismi scatenanti il d. consente al momento solo un trattamento sintomatico e non causale. Si utilizzano spesso farmaci ad azione centrale (anticonvulsivanti e antidepressivi triciclici), che possono condurre a significativi effetti collaterali. Matteo Caleo
L’effetto placebo sul dolore
Il placebo (➔) è una preparazione farmaceutica a base di una sostanza farmacologicamente inerte, che viene somministrata per gli effetti psicologici che può avere sul paziente, e che è capace di migliorare le condizioni cliniche del soggetto. È possibile estendere il concetto di placebo anche a trattamenti diversi da quelli farmacologici: esistono infatti strumenti placebo (strumenti lasciati spenti e quindi non realmente utilizzati dal medico) e interventi chirurgici placebo, in cui il medico anestetizza il paziente e accede alla parte malata, ma non interviene su di essa.
L’effetto placebo
Per effetto placebo si intende tutto il complesso di reazioni attivate nel soggetto che ha ricevuto un trattamento placebo. In effetti si è riscontrato che l’assunzione di sostanza, consigliata o somministrata dal medico, determina sovente nel paziente una reazione psicologica positiva e quindi una pronta ripresa di funzioni, per es. quella gastrointestinale, sotto importante controllo neurovegetativo, fornendo altresì elementi di aspettativa di guarigione (soggettiva) o di reale miglioramento (oggettivo). Il medico gioca un ruolo fondamentale in questo contesto, poiché è in grado di convincere il paziente che il farmaco o il trattamento che sta per assumere lo farà stare meglio: numerose prove cliniche dimostrano che uno stato emotivo tranquillo e fiducioso è accompagnato da una maggior efficacia dei trattamenti farmacologici. È indispensabile anche che il paziente ritenga che la sostanza somministrata sia dotata di un principio farmacologicamente attivo, proprio perché come tale gli viene proposta dal medico in cui egli ripone fiducia. A sostegno di questa fiducia, è fondamentale che il placebo sia indistinguibile dal farmaco e non presenti caratteristiche organolettiche peculiari. colore, sapore, odore, dimensioni, peso, consistenza e, in senso lato, fisicità del placebo devono per definizione essere l’esatta replica del farmaco, senza peraltro contenere principi attivi. L’effetto placebo, quindi, è un fenomeno psicobiologico in cui l’innescarsi di un nuovo stato emotivo determina precisi cambiamenti all’interno del nostro cervello. In pratica il sistema nervoso, in risposta al significato pieno di attese dato alla terapia prescrittagli, innesca modificazioni neurovegetative e produce una serie numerosa di endorfine, ormoni, mediatori, capaci di modificare la sua percezione del dolore, i suoi equilibri ormonali, la sua risposta cardiovascolare e la sua reazione immunitaria. Queste risposte del sistema nervoso comprendono meccanismi sia consci (che coinvolgono anche processi cognitivi) sia inconsci. La coscienza gioca un ruolo fondamentale poiché la risposta a un trattamento dipende dalle aspettative che il medico riesce a creare nel paziente: per es., nei malati di morbo di Alzheimer, i cui processi cognitivi sono compromessi, l’effetto placebo è molto ridotto. Nei meccanismi inconsci, come la secrezione ormonale o l’attività del sistema immunitario, l’effetto placebo si innesca dopo una fase di ‘condizionamento’ in cui il paziente impara ad associare il trattamento alla scomparsa di un sintomo, quale il dolore fisico. Se, dopo la fase di condizionamento, il medico somministra al paziente un trattamento identico ai precedenti, ma privo di principio attivo, l’effetto terapeutico non cambia.
Effetto placebo e terapia del dolore
L’effetto placebo è molto evidente nelle terapie del dolore, dell’ansia e della depressione. Un esperimento importante a tal proposito è quello condotto dai medici e farmacologi Levine e fields a San francisco, nel 1978. In questo studio, i soggetti trattati con placebo raggiungevano uno stato di analgesia che poteva essere abolito somministrando il naloxone, un antagonista dei recettori per gli oppioidi; ciò dimostra che il trattamento placebo causa la liberazione di oppioidi endogeni. Esperimenti più recenti, svolti con l’aiuto di diverse tecniche non invasive in grado di visualizzare l’attività del cervello (PEt), dimostrano che la somministrazione di placebo attiva diverse aree: giro cingolato, corteccia prefrontale e orbitofrontale, insula, nucleus accumbens, amigdala, talamo, sostanza grigia periacqueduttale. Queste aree sono coinvolte nel controllo fisiologico del dolore, nella risposta allo stress, nel determinare gli stati emozionali e in molte funzioni cognitive. come già accennato, l’effetto placebo è condizionato dal contesto in cui la somministrazione avviene: se il trattamento è effettuato in un ambiente ostile o da personale che lascia intravedere effetti spiacevoli, si può osservare un effetto opposto, denominato effetto nocebo, in cui il paziente sperimenta uno stato di malessere che può mimare gli effetti indesiderati di un farmaco. In situazioni del genere sono state misurate alterazioni dei neurotrasmettitori endogeni del tutto opposte a quelle osservate con l’effetto placebo. Dati i suoi potenti effetti, il trattamento con placebo è una componente essenziale nelle sperimentazioni cliniche che mirano a valutare l’efficacia di nuovi farmaci. In partic., le misure sperimentali (per es., intensità del dolore) vengono registrate in parallelo su pazienti che assumono il principio attivo e su pazienti che ingeriscono un placebo. Il protocollo sperimentale viene condotto in doppio cieco, ciò rimane ignoto ‘chi assuma cosa’ sia al paziente sia al medico, perché le confezioni dei prodotti sono identiche e differenziabili unicamente in base a un codice la cui corrispondenza è nota solo a una terza parte esterna all’esperimento. tuttavia, partendo dal principio che occorre assicurare ai pazienti la più efficace cura possibile, trattare alcuni di essi con sostanze inerti farmacologicamente pone problemi di carattere etico in questo tipo di sperimentazioni. Oggi l’uso del placebo è ammesso in alcuni casi generali, per es. quando non esiste una cura di provata efficacia; in ogni caso, tale possibilità è sempre valutata da opportuni comitati etici.
Rappresentazione interna del dolore
La percezione del dolore comprende l’attivazione di un sistema sensoriale (sistema della nocicezione) che è modulato da una serie di fattori modificatori, che vanno dalla memoria di precedenti eventi dolorosi alle influenze psicologiche, incluso lo stato di stress, l’alterazione dell’umore, l’attesa del trattamento e la speranza di guarigione. come per altre modalità, il dolore non è semplicemente un’esperienza sensoriale, ma piuttosto il risultato di un’elaborazione svolta a un livello superiore. In questo senso, il sistema nervoso centrale non rappresenta un semplice ricevitore di impulsi nervosi afferenti, sensitivi o dolorifici, ma svolge un ruolo cruciale di elaborazione di questi ingressi.
Le vie del dolore
Per quanto riguarda la nocicezione, il segnale proveniente dalla periferia giunge nelle corna dorsali del midollo spinale. I neuroni nocicettivi di secondo ordine, con il corpo cellulare nelle corna dorsali, sono distinti in due tipi: quelli che rispondono a deboli stimolazioni e che incrementano la risposta quando lo stimolo diviene più intenso (nocivo) e quelli che rispondono a stimoli esclusivamente nocivi. Questi neuroni sono rispettivamente definiti WDr (Wide Dynamic Range, neuroni ad ampio range dinamico) e NS (Nociceptive-Specific, neuroni nocicettivi specifici). Lo stimolo dolorifico viene trasferito dalle corna dorsali all’encefalo tramite tre vie principali: il tratto spinotalamico, quello spinoreticolare e quello spinomesencefalico. Il tratto spinotalamico è la principale via dolorifica che risale il midollo spinale. Questa via raggiunge il talamo e da qui prosegue per la corteccia somatosensoriale localizzata nel giro postcentrale. Il tratto spinoreticolare termina nella formazione reticolare del ponte, nella quale sono presenti neuroni di proiezione che inviano i loro messaggi al talamo (nei due lati dell’encefalo). Da qui l’informazione è trasportata a molte aree cerebrali, tra cui la corteccia cingolata anteriore e l’amigdala. Queste due aree sono importanti per il processamento della componente emozionale del dolore e per la memoria del dolore. Una terza via ascendente è il tratto spinomesencefalico, che proietta alla sostanza grigia circostante l’acquedotto di Silvio. Da qui la via prosegue verso il nucleo parabrachiale del tronco encefalico, che a sua volta si connette con l’amigdala e altre strutture del sistema limbico. Una quarta via è il tratto spinoipotalamico, che proietta direttamente alle aree di controllo del sistema nervoso autonomo, attivando complesse risposte neuroendocrine e cardiovascolari.
Strutture cerebrali coinvolte nella percezione del dolore
Il dolore è un’esperienza multidimensionale che accoppia alla nocicezione aspetti emozionali e cognitivi. Da un lato il dolore può portare ad ansia e depressione; d’altro canto, pazienti con ansia o depressione hanno una più intensa percezione del dolore e sono più soggetti a sviluppare forme di dolore cronico. Quindi, lo stato emotivo può influenzare in maniera molto robusta la percezione del dolore. Il dolore può anche alterare le funzioni corticali e interferire con le normali capacità di prendere decisioni; similmente, processi cognitivi possono modulare la percezione del dolore. ci sono quindi complesse interazioni tra fenomeni cognitivi, percezione del dolore e aspetti emozionali. Una più precisa comprensione di queste interazioni è essenziale per valutare e trattare appropriatamente il dolore. In questo contesto, un importante aiuto per analizzare i vari aspetti della percezione del dolore viene da tecniche non invasive di analisi dell’attività cerebrale, quali la tomografia a emissione di positroni (PEt) e la risonanza magnetica funzionale. Queste tecniche hanno permesso di identificare una vera e propria rete di strutture cerebrali (detta matrice del dolore), il cui pattern di attivazione segnala precisi aspetti della percezione del dolore. Questa rete comprende aree già citate in precedenza, come la corteccia somatosensoriale primaria e secondaria, la corteccia insulare, la corteccia cingolata anteriore, e i nuclei talamici. Inoltre, la matrice del dolore include specifiche porzioni della corteccia prefrontale e strutture del sistema limbico (in particolare l’amigdala). L’area più legata agli aspetti sensoriali discriminativi del dolore è senz’altro la corteccia somatosensoriale. I neuroni di questa corteccia presentano campi recettivi solitamente piccoli e sono in grado di codificare molto precisamente la sorgente dello stimolo dolorifico. La dimensione psicoemotiva (riguardante la spiacevolezza, il fastidio, il turbamento indotto dalla sensazione provata) dell’esperienza dolorifica è codificata invece in altre strutture. Il ‘nodo’ emotivo della matrice del dolore include la corteccia cingolata, il sistema limbico e l’insula. Le lesioni dell’insula, in partic., provocano una specifica riduzione della risposta emotiva al dolore, che in alcuni casi porta alla cosiddetta asimbolia per il dolore, nella quale il soggetto percepisce lo stimolo doloroso senza manifestare reazioni psicologiche appropriate. La corteccia cingolata e la corteccia insulare sembrano anche costituire un sistema empatico-rievocativo dell’esperienza dolorosa, che rende possibile capire e condividere il dolore altrui. In partic., studi hanno utilizzato la risonanza magnetica per analizzare l’attività cerebrale di volontari che ricevevano uno stimolo doloroso in prima persona, o erano avvertiti mediante uno stimolo visivo che il loro partner (presente nella stessa stanza) stava ricevendo una stimolazione dolorosa simile a quella da loro precedentemente ricevuta. mentre la corteccia somatosensoriale veniva ‘accesa’ solo dalla stimolazione dolorosa diretta, entrambe le situazioni sperimentali erano in grado di attivare sia la corteccia cingolata anteriore sia la corteccia insulare. Quindi empatizzare e partecipare al dolore degli altri attiva il sistema corticale per la rappresentazione della componente psicologica del dolore, mentre la componente sensoriale-discriminativa della matrice del dolore si attiva soltanto durante l’esperienza dolorosa diretta.