trapianto
trapianto
Trasferimento di un tessuto o di un organo da una regione all'altra dello stesso organismo (omotrapianto) o da un organismo all'altro della stessa specie (allotrapianto) o di specie diversa (xenotrapianto). Con donatore e ospite (o ricevente) si indicano rispettivamente il soggetto dal quale viene prelevato l’organo o il tessuto da asportare e colui che lo riceve. L’organo può essere prelevato da un soggetto deceduto (donatore in morte cerebrale), oppure da un soggetto vivo (donatore vivente). Oltre ai t. di rene, fegato e cuore, ampiamente diffusi, sono praticati tra gli altri anche il t. del polmone, del pancreas, della cornea (cheratoplastica) e, in misura minore, dell'intestino.
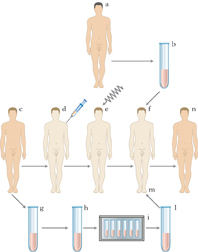
L’iter pre-espianto
Il prelievo degli organi solidi viene generalmente eseguito da donatori cadaveri il cui cuore è ancora battente, in condizioni quindi di morte cerebrale. Il decreto del Ministero della salute 11 apr. 2008 richiede, per l'accertamento di morte nei soggetti affetti da lesioni encefaliche e sottoposti a misure rianimatorie, la contemporanea presenza di condizioni quali lo stato di incoscienza, l’assenza di riflessi del tronco encefalico, l’assenza di respirazione spontanea dopo sospensione della ventilazione artificiale, l’assenza di attività elettrica cerebrale documentata dall’elettroencefalogramma. In alcune circostanze, se vi sono dubbi, per l’accertamento della morte cerebrale è necessario documentare l’assenza di flusso ematico nel cervello. L'idoneità al prelievo degli organi viene stabilita dai responsabili delle varie squadre chirurgiche, sulla base degli accertamenti ematochimici, sierologici, emogasanalitici e strumentali eseguiti sul potenziale donatore. Spesso l’organo viene sottoposto a una biopsia prima di procedere al t., in modo da valutare l’integrità delle sue cellule.
Trapianti e rigetto
Le differenze individuali alla base del fenomeno del rigetto dell'organo trapiantato derivano dal complesso maggiore di istocompatibilità MHC (➔ HLA), costituito da geni che codificano la sintesi di antigeni espressi sulla membrana cellulare di macrofagi, linfociti, cellule endoteliali ed epiteliali. La reazione immunologica di rigetto viene operata dagli antigeni MHC del donatore che, riconosciuti come estranei dal ricevente, scatenano una risposta immunitaria in grado di distruggere l'organo trapiantato. Negli ultimi cinquant’anni diversi farmaci sono stati studiati sperimentalmente e poi utilizzati clinicamente per la prevenzione e il trattamento del rigetto. Tra questi, i primi sono stati gli steroidi e l’azatioprina, che agisce inibendo la differenziazione e la proliferazione dei linfociti T e B attivati. I suoi effetti collaterali più importanti sono rappresentati dalla leucopenia marcata, con conseguente aumento del rischio di infezioni, e dalla epatotossicità. La scoperta della ciclosporina, capostipite di una nuova generazione di farmaci che agiscono in misura maggiore sui linfociti T, prevenendone l'attivazione da parte dell’interleuchina 2, ha significativamente migliorato i risultati di diverse tipologie di trapianto. Anche la ciclosporina non è priva di effetti collaterali, quali epatotossicità, ipertensione arteriosa, neurotossicità e nefrotossicità. Alla fine degli anni Ottanta del secolo scorso è iniziata la sperimentazione di una nuova molecola, il tacrolimus, che negli ultimi 15 anni è divenuto uno dei farmaci antirigetto più efficace in ogni tipo di trapianto d’organo.
Trapianto di rene
Il t. renale rappresenta la terapia di elezione nei pazienti affetti da insufficienza renale terminale di qualsiasi origine. Il primo trapianto di rene è stato eseguito da J. Murray nel 1954. Gli unici fattori in grado di precludere questo t. sono la presenza di neoplasie maligne o, come in ogni altro t., di infezioni sistemiche in atto. Controindicazioni relative sono considerate l'età del ricevente superiore a 60÷65 anni e alcune patologie renali che possono recidivare con una frequenza variabile dopo il t., quali la nefropatia diabetica, la porpora di Schönlein- Henoch, ecc. La sopravvivenza dal trapianto è stimata nel 90% circa a 5 anni.
Trapianto di fegato
Il primo t . di fegato è stato esegui to da T.E. Starzl nel 1963. Le principali indicazioni al t. di fegato sono costituite dalle differenti forme di insufficienza epatica cronica, dall'insufficienza epatica acuta fulminante di origine virale, tossica o da farmaci, dalla cirrosi epatica secondaria a malattie metaboliche, e in pazienti selezionati dalla patologia neoplastica. Le patologie che precludono il t. di fegato sono in pratica limitate alle malattie sistemiche e alle lesioni neoplastiche metastatiche del fegato. Oggi la sopravvivenza dopo il t. di fegato è superiore all’80% a tre anni dal t. e vi sono persone che vivono da oltre 25 anni con un fegato trapiantato.
Trapianto di cuore
Il primo t. di cuore è stato eseguito da C. Barnard nel 1967 a Città del Capo. Il t. cardiaco trova indicazione nell’insufficienza cardiaca terminale intrattabile. Criteri per cui non è indicata la candidatura a t. cardiaco sono un’età troppo avanzata (generalmente sopra i 65 anni), una malattia cerebrovascolare diffusa, la disfunzione irreversibile di altri organi (ad es., rene o fegato), una storia di malattia neoplastica con elevate probabilità di recidiva. I pazienti trapiantati hanno una sopravvivenza stimata del 70% a 5 anni dall’intervento, e del 50% circa a 10 anni.
Il trapianto in corso di leucemie e linfomi
Nelle neoplasie ematologiche viene eseguito sin dagli anni Settanta del secolo scorso il t. di midollo allogenico, che prevede l’impiego preventivo di radiochemioterapie sovramassimali, allo scopo di ottenere una completa eradicazione della malattia con una maggiore probabilità di guarigione. Le radiochemioterapie sovramassimali, per la tossicità ematologica proibitiva che altrimenti determinerebbero, sono utilizzabili solo se seguite dall’infusione di cellule staminali, generalmente di origine periferica, di un donatore compatibile o dello stesso paziente. Tale infusione può consentire di ricostruire una emopoiesi normale. La chemioradioterapia sovramassimale seguita dal t. autologo o allogenico di cellule staminali determina un miglioramento significativo della prognosi in alcune forme di leucemia (ad es., nelle leucemie mieloidi acute e croniche, e nelle leucemie linfoidi acute dei bambini), mentre fornisce risultati meno soddisfacenti o è impiegata in forma ancora sperimentale nelle leucemie linfoidi acute dell’adulto e nella leucemia linfatica cronica. Nei linfomi non Hodgkin ad alto grado di malignità i risultati ottenuti con la chemioterapia tradizionale sono molto favorevoli, per cui la terapia sovramassimale e il t. sono utilizzati solo in particolari categorie di pazienti a rischio elevato.
Xenotrapianti: miraggio o prospettiva reale?
Lo straordinario progresso nella chirurgia dei trapianti d’organo, a partire dal primo trapianto di rene eseguito il 23 dicembre 1954, ha fatto sì che questa branca della medicina diventasse paradossalmente vittima del proprio successo. Oggi i trapianti sono considerati una terapia consolidata e nel mondo sono centinaia di migliaia i malati che attendono la sostituzione di un organo per curarsi da una malattia che mette a rischio la loro vita. Purtroppo molti pazienti muoiono in lista d’attesa mentre attendono la disponibilità di un donatore compatibile. Anche per ovviare alla cronica carenza di organi si è iniziato a pensare di ricorrere agli animali come fonte di organi da trapiantare; e dalla fine degli anni Ottanta del secolo scorso a oggi sono stati compiuti notevoli sforzi nella ricerca di animali compatibili con l’uomo per poter eseguire il cosiddetto xenotrapianto, ossia il trapianto di organo tra specie diverse. In realtà le prime sperimentazioni risalgono all’inizio del 20° sec.
I tentativi pioneristici
I primi tre tentativi clinici di xenotrapianto furono eseguiti in Francia e Germania nel 1906, facendo uso di un maiale, una capra e un macaco come donatori di rene. Nessuno degli organi utilizzati riuscì a funzionare: gli interventi si conclusero con l’immediata trombosi dei vasi (una complicanza dovuta al rigetto iperacuto) e tutti i pazienti morirono in meno di 3 giorni. Nel 1923 negli Stati Uniti venne eseguito dal chirurgo Harold Neuhof (1884-1964) un nuovo tentativo utilizzando un agnello come donatore di rene e il paziente sopravvisse nove giorni. L’attenzione dei ricercatori non si rivolse più a questo tipo di chirurgia fino agli anni Sessanta quando si iniziò a riflettere sul problema della scarsità di organi. Una grande speranza si accese nel 1963: l’8 ottobre di quell’anno Keith Reemtsma (1925-2000) della Tulane University di New Orleans utilizzò un macaco come donatore di rene per trapiantare un paziente, che tuttavia sopravvisse solo dodici giorni. Reemtsma proseguì però con i suoi tentativi utilizzando gli scimpanzè e riuscì a fare sopravvivere per 270 giorni una paziente con un rene funzionante. Si trattò di un successo straordinario in un epoca in cui i farmaci per controllare il rigetto erano ancora primitivi. Sulla scia di questo risultato furono condotti altri esperimenti: T.E. Starzl, utilizzando il protocollo di Reemtsma, tra la fine del 1963 e l’inizio del 1964 utilizzò sei babbuini come donatori di rene per altrettanti pazienti. Gli organi funzionarono e furono in grado di fare sopravvivere i pazienti senza la dialisi, alcuni per 10 giorni fino ad un massimo di 60 giorni. Anche questo rappresentò un traguardo rilevante, in quanto dallo studio degli organi trapiantati si poté dimostrare che utilizzando una combinazione di steroidi e azatioprina, la reazione di rigetto non era differente da quella dopo un trapianto di un organo umano. Sempre alla fine degli anni Sessanta in Francia e in Inghilterra vennero eseguiti tentativi utilizzando organi di suino, ma questi esperimenti dimostrarono grandi problemi dal punto di vista immunologico. Gli ultimi esperimenti clinici rilevanti risalgono al 1984 e al 1992-93. Nel 1984 Leonard L. Bailey (n. 1914) e la sua équipe dell’University Medical Center di Loma Linda in California trapiantarono un cuore prelevato da un babbuino a una neonata di 14 giorni di 2,2 kg. Purtroppo, nonostante il protocollo antirigetto fosse assai più sofisticato di quello utilizzato negli anni Sessanta (basato sull’uso della ciclosporina, di steroidi, di azatioprina e di alcuni speciali anticorpi) la paziente sopravvisse solo tre settimane.
Lo xenotrapianto di fegato
All’inizio degli anni Novanta, a Pittsburgh, con l’introduzione di un nuovo farmaco antirigetto, il tacrolimus, si è pensato che fosse giunto il momento per eseguire con successo uno xenotrapianto di fegato in pazienti che, per motivi clinici, non potevano essere inseriti nella lista d’attesa per un organo umano. Dopo mesi di lavoro in laboratorio, nel giugno 1992 venne eseguito il primo trapianto di fegato da babbuino a uomo della storia della medicina. Il protocollo antirigetto era composto da quattro farmaci: steroidi, prostaglandina E1, ciclofosfamide e tacrolimus. Il paziente trapiantato riprese a respirare da solo dopo diciassette ore dall’intervento e già cinque giorni dopo era in grado di alimentarsi per bocca, arrivando anche a uscire brevemente dall’ospedale. Purtroppo morì dopo 70 giorni a causa di una gravissima infezione dovuta ad Aspergillus flavus. L’utilizzo di Primati per le sperimentazioni dello xenotrapianto suscitò molte critiche soprattutto tra gli animalisti. A Pittsburgh gruppi di attivisti per la difesa degli animali organizzarono manifestazioni all’uscita dell’ospedale e solo gli stessi pazienti in lista d’attesa per un trapianto, scesi in strada tra i dimostranti, riuscirono a fare capire con la propria testimonianza che gli esperimenti in corso non avevano altro scopo che quello di tentare di salvare la vita a molte persone gravemente ammalate.
L’uso dei suini geneticamente modificati
Anche per questi motivi etici i ricercatori negli ultimi anni si sono orientati sui suini che comportano minori implicazioni dato che questi animali vengono utilizzati regolarmente per fini alimentari. L’idea è quella di creare in laboratorio dei maiali geneticamente modificati con l’obiettivo di controllare meglio la reazione di rigetto. La ricerca, finanziata soprattutto con fondi privati, ha portato a buoni risultati ma non ha ancora trovato la soluzione ottimale. Oggi lo xenotrapianto da suino a uomo potrebbe rappresentare il vero obiettivo a cui tendere per eliminare del tutto il problema della carenza di organi umani. Al tempo stesso va ricordato che gli attuali studi sulle cellule staminali potrebbero rendere in futuro del tutto superati i trapianti, grazie alla cura delle malattie non più attraverso la sostituzione dell’organo malato ma all’infusione di cellule staminali in grado di riparare il tessuto o l’organo danneggiato dalla malattia.