sonno
sonno
Il sonno è un processo fisiologico comune alla maggior parte delle specie animali, caratterizzato da un’attività motoria ridotta o assente e da uno stato di marcata dissociazione rispetto agli stimoli sensoriali provenienti dall’ambiente. Lungi dall’essere una condizione di passiva assenza di veglia, il sonno è invece attivamente prodotto da un complesso sistema di interazioni fra tre centri cerebrali: il prosencefalo basale, la formazione reticolare del tronco dell’encefalo e il locus coeruleus. Dal punto di vista dell’attivazione cerebrale, il sonno non si presenta omogeneo, ma appare invece suddiviso in fasi e stadi, che si susseguono regolarmente e si differenziano nei ritmi (onde) registrabili mediante l’elettroencefalogramma. La rilevanza temporale del sonno (gli esseri umani trascorrono circa un terzo della loro vita dormendo) e la sua notevole affermazione nel corso dell’evoluzione suggeriscono che si tratti di un processo funzionalmente importante, ma il suo reale significato biologico è ancora oggetto di studi e resta controverso. [➔ cervello, struttura e funzione del; elettroencefalografia; insonnia; memoria; sogno] Fino al 1945 molti scienziati ritenevano che il s. fosse conseguenza della ridotta attività cerebrale causata dalla fatica accumulata durante la veglia. Secondo tale spiegazione, mentre lo stato di veglia è mantenuto attivamente dalla stimolazione sensoriale, il cervello si addormenta passivamente quando, a causa della fatica, diminuisce il livello della percezione degli stimoli sensoriali. Tra la fine degli anni Quaranta e l’inizio degli anni Cinquanta del 20° sec., le scoperte di Giuseppe Moruzzi misero in crisi l’ipotesi che l’innesco e il mantenimento del s. funzionassero in tale modo. Moruzzi e Horace Magoun scoprirono che la sezione delle fibre sensoriali ascendenti che veicolano al cervello le informazioni sugli stimoli sensoriali, eseguita all’altezza del tronco encefalico, non interferiva né con la veglia né con il sonno. Al contrario, lesioni alla formazione reticolare del tronco encefalico, sebbene non interessassero le fibre sensoriali ascendenti, producevano un pattern elettroencefalografico caratteristico del s., mentre la stimolazione della formazione reticolare induceva il risveglio in un animale addormentato. I due studiosi conclusero che l’attività della formazione reticolare mantiene il cervello sveglio, mentre la riduzione dell’attività di tale area è responsabile del sonno. Pertanto, il s. non fu più considerato un evento passivo, ma piuttosto uno stato regolato attivamente da precise aree cerebrali. Circa una decina di anni dopo Moruzzi fece un’ulteriore fondamentale scoperta: la sezione della formazione reticolare del tronco dell’encefalo a livello del ponte provoca una riduzione evidente del sonno. La scoperta suggeriva un ruolo dinamico della formazione reticolare, che risultava non avere un’azione uniforme nella regolazione del sonno. In partic., la porzione rostrale della formazione reticolare situata al di sopra del ponte contiene neuroni che contribuiscono alla stato di veglia. L’attività di tali neuroni è normalmente inibita dalla porzione di formazione reticolare situata sotto il ponte.
Stadi del sonno
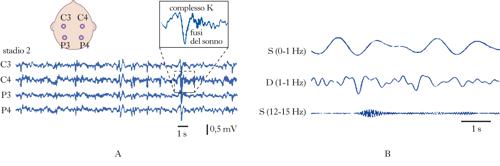
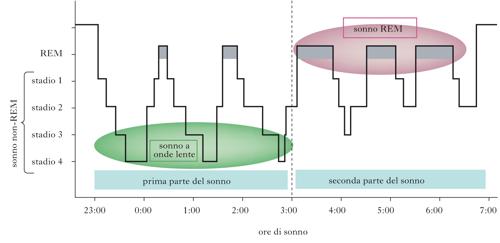
Come scoperto dal gruppo di Nathaniel Kleitman, il s. può essere diviso in due fasi principali. una fase, chiamata s. REM (Rapid Eye Movement), è caratterizzata da movimenti rapidi degli occhi; l’altra fase è caratterizzata dall’assenza di tali movimenti ed è chiamata s. non-REM. L’alternanza delle due fasi può essere seguita registrando i cambiamenti dell’attività cerebrale rilevabile mediante registrazione dell’elettroencefalogramma (➔ elettroencefalografia). Negli uomini, la prima fase del s. è il s. non-REM, durante il quale l’attività e il tasso metabolico del cervello scendono ai valori più bassi. Il s. non-REM può essere diviso in quattro stadi caratteristici. Lo stadio 1 segna il passaggio dalla veglia all’inizio del s.: mentre un individuo sveglio e vigile presenta un’attività elettroencefalografica ad alta frequenza (attività desincronizzata, 16÷25 Hz), che si riduce a circa 10 Hz (ritmo alfa) quando l’individuo si rilassa a occhi chiusi, il passaggio allo stadio 1 del s. è caratterizzato dall’emergere di frequenze più basse. Nello stadio 2 compaiono treni di onde sinusoidali chiamati fusi del s. (12÷14 Hz) e onde bifasiche ad alto voltaggio chiamate complessi K, mentre lo stadio 3 e lo stadio 4 sono caratterizzati da onde a bassa frequenza (ritmo delta, 0,5÷2 Hz). Gli stadi 3 e 4, pertanto, sono anche chiamati s. a onde lente (SWS, Slow Wave Sleep). Durante il passaggio al s. REM, le onde cerebrali diventano più irregolari, di frequenze miste e di basso voltaggio, una caratteristica simile alla veglia. Per questo motivo il s. REM è anche detto s. paradosso. In realtà, gruppi di neuroni localizzati nel ponte, nel nucleo genicolato laterale del talamo e nella corteccia occipitale sono più attivi durante il s. REM che durante la veglia, generando potenziali d’azione ad alto voltaggio denominati ponto-genicolo-occipitali (PGO), correlati con i movimenti oculari tipici del s. REM. Durante tale stadio, la temperatura e il tasso metabolico del cervello aumentano ma il tono muscolare è assente, a eccezione dei muscoli responsabili del controllo dei movimenti degli occhi, del diaframma e degli ossicini dell’orecchio. Mentre l’atonia e l’abbassamento dell’attività cerebrale caratteristici del s. REM lo rendono una fase di s. apparentemente più profonda rispetto al s. non-REM, il s. REM appare più ‘leggero’ se si considera la maggiore probabilità che un individuo in tale stadio vada incontro a episodi di risveglio spontaneo. Il s. non-REM e il s. REM si alternano ciclicamente, mostrando variazioni della lunghezza reciproca in funzione dell’età. Alla nascita, la fase REM rappresenta circa il 50% della durata del s. e si distingue dal s. REM dell’adulto per un’atonia meno regolare. Dopo i 4 anni di età, la durata della fase REM si riduce raggiungendo i valori tipici dei giovani adulti (20÷25%), per poi ridursi ulteriormente all’aumentare dell’età. Le onde lente del s. non-REM sono assenti alla nascita, compaiono durante il primo anno di vita, si stabilizzano attorno ai 3÷11 anni di età e si riducono progressivamente a partire dall’adolescenza, scomparendo quasi del tutto negli individui ultracinquantenni. Anche la durata complessiva del s. si modifica con l’età, passando da ca. 18 ore alla nascita, a 10÷12 h all’età di 4 anni (quando brevi periodi di s. lasciano il posto a un episodio unico e continuo) e infine stabilizzandosi su 7÷8,5 h dai 20 anni in poi. I giovani spendono la maggior parte del s. nello stadio 2 del s. non-REM. Generalmente gli adulti iniziano a dormire mediante un progressivo passaggio dallo stadio 1 allo stadio 4 del s. non-REM (70′€80′ in totale), seguito da un ritorno allo stadio 3 o allo stadio 2 che precede l’ingresso nella prima fase del s. REM, della durata di circa 10′. L’intero ciclo che va dall’inizio del s. non-REM alla fine della prima fase REM dura circa 90′€110′ ed è ripetuto da 4 a 6 volte in una notte, con progressivi incrementi della durata della fase REM a discapito degli altri stadi del sonno. Mentre il s. REM è solitamente associato a sogni vividi, il s. non-REM è caratterizzato, più che da veri e propri sogni, da pensieri ruminativi non accompagnati da immagini.
Effetti della privazione di sonno
Una serie di studi classici ha dimostrato che la privazione di s. nel ratto produce una tipica sindrome fisiologica che conduce alla morte in 2÷3 settimane. Il paradigma della privazione prevede una riduzione di s. del 70÷90%: a livello fisiologico si osserva un aumento iniziale della temperatura corporea e dell’appetito, accompagnato però da un marcato calo del peso dell’animale. Successivamente la temperatura si abbassa, il pelo scolorisce e sulla pelle compaiono numerose lesioni, seguite da infezioni batteriche rilevabili nel sangue, che conducono rapidamente alla morte. Negli uomini, invece, la privazione protratta di s. (fino a 11 giorni) non evoca cambiamenti fisiologici bruschi, mentre si registra una tendenza all’aumento del peso piuttosto che al dimagrimento. Alcune persone, però, sviluppano una rara condizione genetica denominata insonnia fatale familiare (➔), che comporta la completa impossibilità di dormire da una certa età in avanti, con esito fatale in un periodo medio di 7÷24 mesi. Anche tali individui presentano infezioni batteriche diffuse, mentre l’analisi autoptica del loro cervello evidenzia degenerazioni talamiche probabilmente responsabili dell’insonnia. La completa assenza di s. è incompatibile con la vita e la sua privazione induce un aumento della quantità di s. nelle ore successive. Malgrado tutti gli studiosi riconoscano che il s. è un processo biologico necessario e nonostante gli sforzi della comunità scientifica, le sue funzioni esatte non sono ancora chiare. Attualmente si ritiene che le funzioni più importanti del s. siano la conservazione delle risorse energetiche (necessaria soprattutto nelle ore in cui l’approvvigionamento di cibo è più difficoltoso), il ripristino di funzioni corporee ancora incerte (ma l’azione riposante del s. o la stanchezza generata dalla sua assenza sono fenomeni largamente condivisi), il consolidamento delle tracce mnestiche.
Neurofisiologia del sonno
Come dimostrato dal lavoro pionieristico di Moruzzi e Magoun, lo stato di veglia dipende dall’attività della formazione reticolare del mesencefalo. Anche la stimolazione dei neuroni istaminergici dell’ipotalamo posteriore produce uno stato di attivazione cerebrale simile a quello dovuto alla stimolazione del mesencefalo. Di converso, il s. viene indotto dalla stimolazione elettrica dell’ipotalamo anteriore e del prosencefalo basale, mediante l’attivazione di neuroni inibitori GABAergici responsabili dell’inibizione delle cellule istaminergiche dell’ipotalamo posteriore e dei neuroni della formazione reticolare mesencefalica. Se si esegue una sezione completa del cervello all’altezza del mesencefalo, tra i collicoli superiori e inferiori (preparato cerveau isolé), la porzione del cervello al di sopra del taglio esibisce un’attività EEG costante tipica del s. a onde lente. Se la sezione viene eseguita più caudalmente tra il bulbo e il midollo spinale (preparato encéphale isolé), così da lasciare intatte le afferenze dei nervi cranici V e VIII, il cervello mostra normali cicli s.-veglia. I fusi e le onde lente caratteristici del s. non-REM sono prodotti dall’attività sinaptica sincronizzata di neuroni corticali stimolati dalla scarica ritmica dei neuroni relé talamici (neuroni che mettono in connessione il talamo con la corteccia). A sua volta, l’attività del talamo è sotto il controllo inibitorio dei neuroni GABAergici del nucleo reticolare, responsabili della genesi dei fusi del s. in un processo in cui un ruolo chiave è svolto dal calcio. Quando i neuroni del nucleo reticolare sono iperpolarizzati, il calcio entra all’interno delle cellule attraverso speciali canali di membrana voltaggio dipendenti, depolarizzandole e attivando una scarica di potenziali d’azione. La ripolarizzazione che accompagna la fine dei potenziali d’azione segna l’inizio di un nuovo ciclo di ingresso di calcio, col risultato che l’attività dei neuroni reticolari diviene ritmica. Il GABA rilasciato da tali neuroni iperpolarizza i neuroni talamocorticali, riducendo la soglia di attivazione di potenziali d’azione calcio-dipendenti. La scarica ritmica dei neuroni talamocorticali, a sua volta, induce potenziali sinaptici sincroni nei neuroni corticali, responsabili dei fusi registrati tramite l’EEG, e inibisce la trasmissione di informazioni sensoriali dal talamo alla corteccia. Durante il s. REM i fusi e le onde lente sono assenti. La generale riduzione del voltaggio è dovuta all’attività di neuroni colinergici localizzati nel mesencefalo e nella regione dorsale del ponte. Tali neuroni si attivano durante il s. REM e il risveglio depolarizzando, mediante il rilascio di acetilcolina, i neuroni inibitori GABAergici del nucleo reticolare del talamo. La depolarizzazione di tale area previene l’attivazione dei canali calcio a bassa soglia, bloccando la scarica sincrona dei neuroni reticolari e quindi desincronizzando anche l’attività delle cellule relé talamocorticali. Anche i neuroni della formazione reticolare, che si estende dalla regione rostrale del ponte al mesencefalo caudale, sono importanti per la genesi del s. REM, come dimostrato dal fatto che l’ablazione bilaterale di tale struttura lo sopprime. Le cellule colinergiche della formazione reticolare, denominate PGO-on (Ponto-Genicolo-Occipitale), sono responsabili dei potenziali d’azione PGO che originano nel nucleo genicolato laterale del talamo. L’attività delle cellule PGO-on è inibita dalle cellule serotoninergiche del nucleo del rafe attive durante la veglia, ma silenti nel passaggio dal s. non-REM al s. REM. Anche l’attività dei neuroni noradrenergici del locus coeruleus e dei neuroni istaminergici dell’ipotalamo cessa nel passaggio al s. REM. Importanti per il controllo del s. REM sono anche i neuroni REM-on, i neuroni noradrenergici e le cellule che proiettano ai motoneuroni responsabili dei movimenti della testa, delle braccia e degli occhi. L’inibizione del tono muscolare durante il s. REM è dovuta proprio all’attività dei neuroni REM-on.
Filogenesi del sonno
Benché, a differenza dell’uomo, il s. negli altri animali non sia sempre immediatamente evidente o distinguibile da episodi di quiete caratterizzati da attività cerebrale ridotta, si ritiene che la maggior parte degli animali dorma. Fra gli insetti, sembra che si possa parlare di s. almeno per Drosophila e per le api, anche se le grandi differenze del sistema nervoso di questi animali rispetto a quello dei mammiferi non consentono di capire se si tratta di un processo omologo o solamente analogo al s. dei vertebrati superiori. Nei pesci, l’esistenza del s. è dimostrata nel pesce zebra da variazioni circadiane di attività e dal calo di responsività agli stimoli ambientali, osservabile a seguito di periodi di mancanza di riposo adeguato. In alcune specie di teleostei della barriera corallina, però, si osserva un’attività continua sia durante il giorno sia durante la notte ed è stato pertanto proposto che tali animali possano effettuare una sorta di sleep swimming. L’esistenza del s. negli anfibi è invece controversa: in alcune specie, uno stato di vigilanza continua potrebbe essersi evoluto come meccanismo adattativo per ridurre il rischio di predazione; alcune raganelle, invece, esibiscono veri e propri periodi di s. non-REM. Nei rettili esistono senz’altro lunghi periodi di quiescenza durante i quali l’attività cerebrale si riduce, ma non sono mai state descritte né le onde cerebrali tipiche del s. REM, né le onde lente caratteristiche del s. non-REM. Negli uccelli il s. REM e il s. non-REM possono invece essere individuati con criteri elettroencefalografici certi. Gli uccelli hanno periodi di s. REM molto brevi e, in generale, la durata del s. va incontro a notevoli cambiamenti stagionali in funzione dell’attività migratoria (il s. si riduce di circa due terzi durante la stagione della migrazione).
Il sonno nei mammiferi. Tra i mammiferi, specie addomesticate come ratti, topi, gatti, cani e scimmie mostrano fasi di riposo che soddisfano completamente la definizione di sonno. In natura, la presenza o meno di periodi di s. è strettamente collegata al rischio di predazione e alla facilità di ottenere cibo. Si ritiene che, tra i grandi erbivori, le giraffe e gli elefanti siano troppo vulnerabili per andare incontro a periodi di ridotta responsività agli stimoli ambientali. Quando la disponibilità di cibo è fortemente ridotta, per molte specie la migliore strategia di sopravvivenza consiste nell’aumentare la quantità di sonno. Il s. REM è presente in quasi tutti i mammiferi. I cicli di s. REM variano in durata in relazione alle dimensioni degli animali: gli elefanti hanno il ciclo più lungo mentre i piccoli mammiferi presentano cicli più brevi (per es., il gatto ha un ciclo di s. di circa 22′, mentre il ratto di circa 12′). Nei mammiferi marini, l’attività cerebrale durante il s. cambia a seconda che l’animale si trovi in acqua o sulla terraferma. Sulla spiaggia, l’attività elettroencefalografica durante il s. nelle foche appare sincronizzata bilateralmente nei due emisferi cerebrali e si assiste all’alternanza di fasi di s. REM e di s. non-REM. In acqua, le foche mostrano un pattern comportamentale asimmetrico, con una pinna attiva deputata al mantenimento della postura corporea e l’altra pinna tenuta a riposo; onde cerebrali a bassa frequenza caratteristiche del s. sono presenti solamente in un emisfero e l’animale tiene chiuso l’occhio controlaterale all’emisfero inattivo; ciò ha portato alla nota affermazione secondo cui i mammiferi marini dormono solo con metà del cervello. Questo fenomeno è particolarmente evidente nei delfini e negli altri cetacei, nei quali onde lente tipiche del s. compaiono alternativamente nei due emisferi e gli animali sono addirittura capaci di dormire durante il nuoto mantenendo un’attività motoria simmetrica, a differenza di quanto riscontrato nelle foche. La capacità di dormire solo con metà cervello sembra essersi evoluta in relazione alla necessità di mantenere un continuo stato di allerta e di risposta agli stimoli ambientali, al fine di evitare collisioni durante il nuoto. I delfini, inoltre, non presentano s. REM, un adattamento ritenuto essenziale per assicurare agli animali il tono muscolare necessario al periodico riemergere in superficie per respirare.
Disturbi del sonno
Esistono numerosi disturbi del sonno, dei quali alcuni derivati da altre patologie che interessano la veglia ma che si ripercuotono anche sulle fasi di riposo notturno, altri definibili come disturbi di sonno primari. Un’utile classificazione dei disturbi di sonno primari distingue tra disturbi associati a sonno in eccesso, disturbi legati a carenza di sonno (➔ insonnia), e disturbi del sonno REM e del sonno non-REM.
Disturbi associati a sonno in eccesso
Tali disturbi comportano difficolta o impossibilita a controllare il sonno durante le ore diurne e attacchi di sonno improvviso che creano problemi allo svolgimento delle normali attività lavorative; sono molto rischiosi quando insorgono durante attività impegnative quali la guida di autoveicoli. Nonostante i disturbi che comportano sonno in eccesso siano meno diffusi nella popolazione rispetto a quelli da privazione di sonno, il loro carattere debilitante fa si che gli individui affetti si rivolgano alle cure mediche più di frequente. La sindrome narcolettica è caratterizzata da frequenti attacchi incontrollabili di sonno diurno, di durata compresa tra i 5′ e i 30′ e, in molti individui, da cataplessia (completa o parziale perdita del tono muscolare, senza perdita di coscienza) indotta da emozioni forti, come la rabbia o il riso. Altri sintomi della patologia includono frequenti risvegli notturni e una latenza di inizio del sonno ridotta (2′÷3′ rispetto ai 10′÷15′ degli individui normali). La cataplessia viene vissuta coscientemente dai pazienti, che sono in grado di ricordarla; compare nei momenti di transizione tra la veglia e il sonno, quando risulta associata anche ad allucinazioni visive, o al risveglio. A livello comportamentale, la frequenza degli episodi porta a un peggioramento delle performance lavorative e delle abilità mnemoniche. Gli individui affetti da tale sindrome entrano nel sonno direttamente dalla fase REM e la rilevanza di tale fenomeno è tale da renderlo un segno inequivocabile della presenza della patologia. La narcolessia ha un’incidenza familiare accentuata ed è spesso associata a malattie autoimmuni, come la sclerosi multipla. Gli individui affetti da narcolessia presentano una perdita massiccia di neuroni ipotalamici contenenti ipocretina, un neuropeptide coinvolto nel controllo del sonno e nella prevenzione di passaggi immediati dalla veglia al sonno REM. I neuroni ipotalamici contenenti ipocretina proiettano ai principali centri encefalici coinvolti nella regolazione del sonno (prosencefalo basale, formazione reticolare e locus coeruleus). Benché alcuni farmaci, come gli antidepressivi triciclici e le anfetamine, siano utili nel trattamento sintomatico della narcolessia, la sindrome è ancora orfana di cure efficaci, e nuove ricerche si stanno concentrando su farmaci capaci di stimolare i recettori per l’ipocretina. Un altro disturbo associato a sonno eccessivo e la sindrome da apnea ostruttiva, nella quale la perdita del tono muscolare scheletrico induce un’ostruzione delle vie aree superiori, con conseguenti episodi di apnea notturna della durata di oltre 10». Altri sintomi tipici sono un forte e continuo russare, un sonno notturno non ridotto in lunghezza totale ma molto frammentato e attacchi di sonno incontrollabili durante il giorno. Come per la narcolessia, la sindrome comporta stanchezza, disturbi di memoria e confusione mentale. Il tracciato elettroencefalografico evidenzia un marcato allungamento della durata dello stadio 1 del sonno non-REM e una riduzione molto accentuata del sonno a onde lente. La malattia ha un’alta incidenza negli individui obesi, nei quali l’accumulo di grasso in eccesso nella regione del collo comporta un rilassamento della muscolatura della gola. Nel sonno, l’ipotonia o la completa atonia dei muscoli scheletrici rende l’azione dei muscoli aerei troppo debole, col conseguente collasso della laringe, interrotto da frequenti episodi di veglia. La cura più efficace per la sindrome da apnea ostruttiva consiste nell’immissione forzata di aria nelle vie respiratorie somministrata mediante una maschera nasale denominata CPAP (Continuous Positive Airway Pressure).
Disturbi del sonno REM e del sonno non-REM
Il disturbo comportamentale nel sonno REM consiste in una grave alterazione del controllo della fase REM che comporta la permanenza del tono muscolare anche durante questa fase del sonno. Di conseguenza, gli individui colpiti dal disturbo si muovono durante il sonno, con comportamenti organizzati e spesso violenti che possono anche essere causa di danni fisici per l’individuo o per il partner. Tali episodi hanno frequenza variabile (due per notte nei casi più gravi, uno ogni 7÷15 giorni nei casi più leggeri) e sono di solito associati a sogni particolarmente vividi. Il disturbo tende a comparire dopo i 50 anni di età, con un’incidenza maggiore negli uomini rispetto alle donne, spesso in concomitanza con l’insorgere della malattia di Parkinson. Nel gatto, una sindrome analoga può essere indotta da lesioni del ponte che distruggono la parte ventrale del locus coeruleus: venendo meno la perdita di tono muscolare tipica del sonno REM, i gatti con tali lesioni esibiscono comportamenti verosimilmente legati al contenuto dei sogni. Il sonnambulismo (camminare nel sonno) consiste in complessi comportamenti automatici, come alzarsi dal letto e camminare anche per distanze notevoli, mentre l’individuo è completamente addormentato. Gli episodi di sonnambulismo avvengono unicamente negli stadi 3 e 4 del sonno a onde lente (sono, pertanto, più frequenti nella prima parte della notte) e sono caratterizzati da onde delta di grande ampiezza nel tracciato elettroencefalografico. Le cause del disturbo non sono note, mentre tra i fattori predisponenti si annoverano la privazione di sonno, il consumo di alcol, la febbre. Altri disturbi del sonno non-REM sono il terrore notturno e l’enuresi (incontinenza notturna), tipici degli stadi infantili.
Sonno e memoria
Mentre durante la veglia vengono codificate le nuove tracce di memoria o recuperate e usate le memorie già disponibili, nel sonno avviene un processo di riconsolidamento delle tracce mnestiche, volto a trasformare le memorie labili acquisite di recente in rappresentazioni stabili, integrate nella rete delle memorie a lungo termine. Tale processo non può avvenire quando l’individuo è sveglio, perché ciò porterebbe a un disturbo reciproco fra la codifica delle memorie in ingresso e il consolidamento di quelle già acquisite, col rischio di allucinazioni fastidiose e incompatibili con lo stato di veglia. Pertanto, si ritiene che una delle ragioni più importanti alla base della comparsa e dell’affermazione evolutiva del sonno negli animali sia proprio quella di garantire una dimensione in cui la perdita momentanea di coscienza renda possibile il riesame e il consolidamento delle informazioni memorizzate.
Studi comportamentali
I benefici del sonno sulla memoria sono proporzionali alla sua quantità, ma effetti misurabili si registrano anche solo dopo 1÷2 h o perfino a seguito di cortissimi episodi di sonno della durata di appena 5'. Il sonno favorisce il consolidamento in tutti i principali sistemi di memoria (➔ apprendimento), ma con effetti più marcati per la memoria esplicita e per informazioni ritenute rilevanti dall’individuo. Un esempio è dato dal compito del tempo di reazione seriale, nel quale il soggetto impara a premere pulsanti specifici in risposta a stimoli spaziali opportuni: il sonno migliora la performance dei soggetti con effetti più robusti quando tale compito viene imparato sia in modo esplicito (al soggetto viene spiegata la sequenza degli indizi spaziali presentati) sia in modo implicito (cioè, quando il soggetto non conosce la sequenza degli indizi), e quando la corretta esecuzione del compito viene premiata da un rinforzo positivo rispetto a quando il test non prevede l’ottenimento di alcun premio. L’effetto di consolidamento indotto dal sonno è misurabile come resistenza all’interferenza prodotta dall’apprendimento di un compito simile (stabilizzazione), e come miglioramento della performance rispetto al periodo precedente il sonno (potenziamento). Talvolta, il sonno può anche modificare le memorie a livello qualitativo, portando i soggetti a risolvere problemi di logica per i quali non erano in grado di dare una soluzione prima dell’episodio di sonno.
Stadi del sonno e memoria
Il ruolo del sonno REM nel consolidamento mnestico è stato inizialmente indagato con protocolli di risveglio forzato all’inizio della fase REM. I risultati ottenuti sono però di difficile interpretazione, poiché tale manovra comporta alti livelli di stress, fattore confondente capace di influenzare i processi di memorizzazione. Anche gli studi farmacologici basati sulla somministrazione di farmaci antidepressivi, capaci di sopprimere la fase REM del sonno (come gli inibitori selettivi del reuptake della serotonina, SSRI), sono poco attendibili, perché tali sostanze agiscono anche sui processi di plasticità sinaptica durante la veglia, con possibili effetti di compensazione. Gli studi più attendibili sull’uomo hanno invece sfruttato la differente durata che la fase REM e il sonno non-REM presentano nelle varie parti della notte. Il sonno a onde lente, infatti, è predominante nella prima parte della notte, mentre il sonno REM diviene più rappresentativo nella seconda meta del riposo notturno. Il sonno a onde lente facilita maggiormente il consolidamento delle memorie esplicite (dichiarative), mentre il sonno REM ha effetti più robusti sulle memorie procedurali.
Basi neurali degli effetti del sonno sul consolidamento delle tracce mnestiche
Numerosi studi hanno dimostrato, nel ratto, la riattivazione delle tracce di memoria durante il sonno. Tali studi hanno principalmente indagato l’attività delle cellule di posizione dell’ippocampo (place cells), neuroni fondamentali per il comportamento spaziale e caratterizzati dal fatto che entrano in attività solo quando l’animale invade, durante l’esplorazione, una certa porzione dello spazio – selettiva per ogni neurone – chiamata campo recettivo di posizione (place field). Gli studi di Bruce McNaughton e Matthew Wilson hanno dimostrato che i pattern spaziotemporali di scarica, attivati durante la veglia dall’esecuzione di un certo compito o dall’esplorazione dell’ambiente, vengono poi riattivati, esattamente nello stesso ordine, durante il successivo episodio di sonno a onde lente. Un processo analogo si verifica anche quando l’animale è sveglio, ma in questo caso le sequenze di riattivazione dei singoli neuroni tendono a presentarsi con un ordine temporalmente invertito. Una dimostrazione diretta del ruolo causale della riattivazione delle tracce mnestiche durante il sonno nel potenziamento della memoria è stata ottenuta mediante un paradigma sperimentale in cui i soggetti dovevano apprendere la posizione di un oggetto all’interno di una griglia bidimensionale mentre erano esposti a un certo odore. La riesposizione allo stesso odore, effettuata mentre i soggetti dormivano nella fase di sonno a onde lente, determinava il potenziamento delle memorie apprese, suggerendo quindi che la riattivazione della traccia mnestica fosse necessaria per il consolidamento della stessa. Il potenziamento della memoria indotto dal sonno è mediato anche da processi di rimodellamento anatomico e di rafforzamento funzionale delle sinapsi (plasticità sinaptica). Nel ratto, l’esposizione a nuovi stimoli tattili durante la veglia aumenta l’espressione di geni immediati precoci coinvolti nella plasticità (come Arc ed Egr1) durante il successivo episodio di sonno, un effetto specifico delle aree precedentemente più attivate in risposta agli stimoli. Studi condotti sulla corteccia visiva hanno inoltre dimostrato che la plasticità associata al sonno dipende dall’attivazione dei recettori per il glutammato di tipo NMDA e dalla proteina chinasi cAMP dipendente di tipo A (PKA).